O6-Methylguanin-DNA-Methyltransferase
O6-Methylguanin-DNA-Methyltransferase (MGMT) (auch 6-O-Methylguanin-DNA-Methyltransferase oder Methylierte-DNA-Cystein-S-methyltransferase) ist ein Protein innerhalb des Zellkerns, das an der Reparatur alkylierter DNA beteiligt ist. MGMT wird in allen Lebewesen gebildet und in jeder Körperzelle. Beim Menschen ist die MGMT-Konzentration in der Leber am höchsten. Die Inaktivierung des MGMT-Gens führt zu Tumorbildung.
| O6-Methylguanin-DNA-Methyltransferase | ||
|---|---|---|
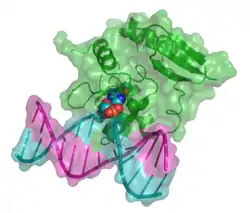 | ||
| Bänder-/Oberflächenmodell von MGMT auf O6-Methylguanyl-DNA nach PDB 1T38. Das nach außen gedrehte Methylguanin ist als Kalotte dargestellt. | ||
|
Vorhandene Strukturdaten: 1eh6, 1eh7, 1eh8, 1qnt, 1t38, 1t39, 1yfh | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 207 Aminosäuren | |
| Kofaktor | Zink | |
| Bezeichner | ||
| Gen-Namen | MGMT ; AGT | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 2.1.1.63, Methyltransferase | |
| Reaktionsart | (De-)Methylierung | |
| Substrat | DNA mit O6-Methylguanin + Protein mit Cystein | |
| Produkte | DNA mit Guanin + Protein mit S-Methylcystein | |
| Vorkommen | ||
| Homologie-Familie | MGMT | |
| Übergeordnetes Taxon | Lebewesen | |
Die Methylierung der DNA hat neben ihren Vorteilen auch Nachteile. Zum Beispiel kann es zur Bildung von 6-O-Methylguanin aus Guanin kommen. Dies passiert innerhalb der DNA und kann zur Bildung von Tumoren führen. Die Reparatur dieses Defekts wird durch MGMT durch die Übertragung der Methylgruppe auf sich selbst bewerkstelligt. Da MGMT bei dieser Reaktion verbraucht wird, ist es strenggenommen kein Enzym. Häufiger wird der Begriff Suizid-Enzym benutzt.
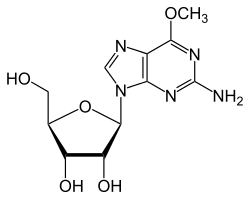
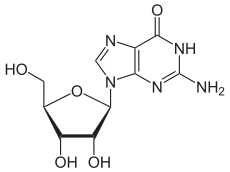
- Entfernen der Methylgruppe aus 6-O-Methylguanosin, Bildung von Guanosin
Der Nachweis von epigenetischen Veränderungen des MGMT-Promotors (Hypermethylierung) geht bei Glioblastomen mit einer besseren Prognose und einem besseren Ansprechen auf eine Chemotherapie mit Alkylantien wie zum Beispiel Temozolomid einher.[1][2] Für den Nachweis der MGMT Promotor-Methylierung für klinische Zwecke eignen sich DNA-basierte Methoden unter Anwendung strikter Qualitätskontrolle, nicht aber der immunhistochemische Proteinnachweis.[3][4]
Einzelnachweise
- Stupp et al.: Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. N Engl J Med. 2005;352:987–996; PMID 15758009.
- Stupp et al.: Effects of radiotherapy with concomitant and adjuvant temozolomide versus radiotherapy alone on survival in glioblastoma in a randomised phase III study: 5-year analysis of the EORTC-NCIC trial. Lancet Oncol. 2009;10(5):459–466; PMID 19269895.
- Preusser M, Charles Janzer R, Felsberg J, Reifenberger G, Hamou MF, Diserens AC, Stupp R, Gorlia T, Marosi C, Heinzl H, Hainfellner JA, Hegi M. Anti-O6-methylguanine-methyltransferase (MGMT) immunohistochemistry in glioblastoma multiforme: observer variability and lack of association with patient survival impede its use as clinical biomarker. Brain Pathol. 2008 Oct;18(4):520-32. doi:10.1111/j.1750-3639.2008.00153.x.
- Reifenberger G, Malzkorn B, Acker T, Bettstetter M, Buslei R, von Deimling A, Dietmaier W, Dubbink HJ, Eigenbrod S, Garvalov BK, Gerstenmaier U, Giese A, Haase D, Hasselblatt M, Kirches E, Koch A, Marienfeld R, Mittelbronn M, Montesinos-Rongen M, Pagenstecher A, Riemenschneider MJ, Prinz M, Romeike B, Roos A, Spiegl-Kreinecker S, Schittenhelm J, Schlegel J, Thal DR, Tops BB, Weis J, Westphal G, Worm K, Felsberg J. Results of the international interlaboratory comparison of mgmt promoter methylation analysis involving twenty-three academic centers in Germany, austria and the Netherlands. Neuro Oncol. 2014 Jul;16 Suppl 3:iii49-iii50. doi:10.1093/neuonc/nou209.30.