Nitrosylfluorid
Nitrosylfluorid ist eine chemische Verbindung aus der Gruppe der Nitrosylverbindungen und der Fluoride.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Nitrosylfluorid | ||||||||||||||||||
| Andere Namen |
Stickstoffoxidfluorid | ||||||||||||||||||
| Summenformel | NOF | ||||||||||||||||||
| Kurzbeschreibung |
farbloses Gas[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 49,00 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
gasförmig[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
Zersetzung bei Kontakt mit Wasser[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Gewinnung und Darstellung
Nitrosylfluorid kann durch folgende Reaktionen gewonnen werden:
- Reaktion von Nitrosyltetrafluoroborat mit Natriumfluorid im Vakuum bei 300 °C[1]
- Reaktion von Stickstoffmonoxid mit Fluor bei Raumtemperatur,[1] wobei Nitrosyltrifluorid als Nebenprodukt entsteht[4]
- Reaktion von Kaliumfluorid mit Stickstoffdioxid[2]
Eigenschaften
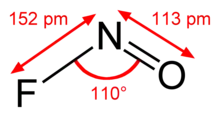
Bindungslängen und -winkel von Nitrosylfluorid
Nitrosylfluorid ist ein farbloses Gas, das als Flüssigkeit durch Verunreinigungen oft bläulich gefärbt ist. In Wasser löst es sich mit blauer Farbe, gibt dann aber rasch Stickstoffmonoxid und Salpetersäure ab. Es reagiert mit Glas heftig, ist gegen Quarz aber beständiger.[1]
Einzelnachweise
- Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 201.
- Charles T. Ratcliffe and Jean´ne M. Shreeve: Nitrosyl halides - A. Nitrosyl fluoride. In: William L. Jolly (Hrsg.): Inorganic Syntheses. Band 11. McGraw-Hill Book Company, Inc., 1968, S. 194–200 (englisch).
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 711.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. The authors of the article are listed here. Additional terms may apply for the media files, click on images to show image meta data.