Nitrosylazid
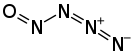
Nitrosylazid (Tetrastickstoffmonoxid) ist ein instabiles Stickoxid, das sowohl als anorganisches kovalentes Azid als auch als Nitrosylverbindung gesehen werden kann. Der Stickstoffgehalt im Molekül beträgt 77,79 %.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Nitrosylazid | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | NON3 | ||||||||||||
| Kurzbeschreibung |
schwach gelber Feststoff[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 72,03 g·mol−1 | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Darstellung und Gewinnung
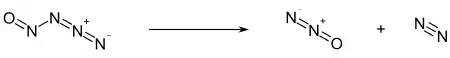
Die erste Herstellung wurde im Jahr 1958 beschrieben.[2] Die Herstellung erfolgt durch die Umsetzung von Natriumazid mit Nitrosylchlorid bei Temperaturen unterhalb von −50 °C.[2][1] Das Produkt wird mittels Vakuumdestillation aus dem Reaktionsgemisch erhalten.[2]
![]()
Anstatt Nitrosylchlorid können als NO-Quelle auch Nitrosylhydrogensulfat und Salpetrige Säure verwendet werden.[2]
Eigenschaften
Nitrosylazid kann unterhalb von −50 °C als schwach gelber Feststoff erhalten werden. Der Schmelzpunkt wird im Bereich von −60 °C bis −55 °C angegeben.[2] Die Dampfdruckfunktion ergibt sich nach August entsprechend lg(P) = −A/T+B (P in Torr, T in K) mit A = 1215,6 und B = 7,306.[2] Durch eine Extrapolation kann ein Normaldrucksiedepunkt von 1,5 °C abgeschätzt werden.[2] Dieser kann praktisch nicht erreicht werden, da die Verbindung oberhalb von −50 °C in Distickstoffmonoxid und Stickstoff zerfällt. Eine quantenchemische Ab-initio-Berechnung ergab für den Zerfall eine stark exotherme Reaktionswärme mit −381 kJ·mol−1.[1]
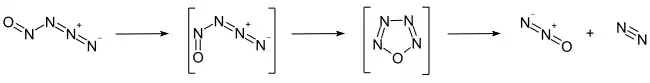
Eine Charakterisierung erfolgte mittels Infrarot-[2] und Raman-Spektroskopie[1], wobei die gemessenen Banden gut mit berechneten Werten für eine trans-Kettenstruktur übereinstimmen.[1] Quantenchemische Berechnungen ergaben eine mit 4,2 kJ·mol−1 energiereichere cis-Kettenform, sowie eine um 54,4 kJ·mol−1 stabilere aromatische 6π-Ringform.[1] Für die Zyklisierungsreaktion müsste wegen der Abwinkelung der Azidfunktion eine sehr hohe Aktivierungsenergie von 205 kJ·mol−1 aufgebracht werden.[1] Das kann als Grund gesehen werden, dass das Nitrosylazid so stabil ist und bei tiefen Temperaturen isoliert werden kann. Die cyclische Form zerfällt schnell in Distickstoffmonoxid und Stickstoff.
Einzelnachweise
- Schulz, A.; Tornieporth-Oetting, I.C.; Klapötke, T.M.: Nitrosyl azide, N4O, an intrinsically unstable oxide of nitrogen in Angew. Chem. Int. Ed. 32 (1993) 1610–1612; doi:10.1002/anie.199316101.
- Lucien, H.W.: The preparation and properties of nitrosyl azide in J. Am. Chem. Soc. 80 (1958) 4458–4460, doi:10.1021/ja01550a004.
- Eintrag zu Stickstoffoxide. In: Römpp Online. Georg Thieme Verlag, abgerufen am 17. April 2014.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.