Nickeldisulfid
Nickeldisulfid ist eine anorganische chemische Verbindung des Nickels aus der Gruppe der Disulfide.
| Kristallstruktur | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
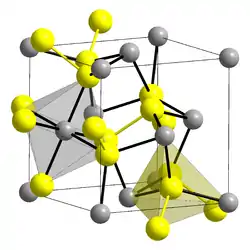 | |||||||||||||
| _ Ni2+ _ S22− | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Nickeldisulfid | ||||||||||||
| Andere Namen |
Nickel(II)-disulfid | ||||||||||||
| Verhältnisformel | NiS2 | ||||||||||||
| Kurzbeschreibung |
dunkeleisengrauer Feststoff[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 122,83 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest[2] | ||||||||||||
| Dichte |
4,45 g·cm−3[3] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser[2] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Gewinnung und Darstellung
Nickeldisulfid kann durch Reaktion von Nickel(II)-sulfid mit Schwefel bei 450 °C gewonnen werden.[4]
Eigenschaften
Nickeldisulfid ist ein antiferromagnetischer schwarzer geruchloser Feststoff, der in Wasser unlöslich ist. In Salpetersäure wird er unter Zersetzung gelöst. Es ist auch im trockenen Zustand luftempfindlich, wobei sich Schwefeldioxid bildet, das am Präparat teilweise adsorbiert bleibt. Es besitzt eine Kristallstruktur vom Pyrit-Typ mit der Raumgruppe Pa3 (Raumgruppen-Nr. 205) und dem Gitterparameter a = 552,4 pm. Die Verbindung kann Schwefel in das Gitter einbauen.[2][4] Er ist mit Eisen(II)- und Cobaltdisulfid Isomorph.[1]
Einzelnachweise
- Heinrich Remy: Lehrbuch der Anorganischen Chemie Band II, Leipzig 1973, Seite 413.
- Datenblatt Nickel sulfide, 99% (metals basis) bei AlfaAesar, abgerufen am 30. Mai 2016 (PDF) (JavaScript erforderlich).
- Jean d’Ans, Ellen Lax, Roger Blachnik: Taschenbuch für Chemiker und Physiker. Springer, 1998, ISBN 3-642-58842-5, S. 644 f. (eingeschränkte Vorschau in der Google-Buchsuche).
- Georg Brauer (Hrsg.) u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band III, Ferdinand Enke, Stuttgart 1981, ISBN 3-432-87823-0, S. 1694.


