Cobaltdisulfid
Cobaltdisulfid ist eine chemische Verbindung aus der Gruppe der Cobaltverbindungen und Disulfide.
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
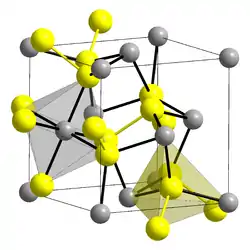 | |||||||||||||||||||
| _ Co2+ _–_ S22− | |||||||||||||||||||
| Raumgruppe |
Raumgruppe Pa3 (Raumgruppen-Nr. 205) | ||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Cobaltdisulfid | ||||||||||||||||||
| Andere Namen |
Kobaltdisulfid | ||||||||||||||||||
| Verhältnisformel | CoS2 | ||||||||||||||||||
| Kurzbeschreibung |
schwarzer geruchloser Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 123,06 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
4,23 g·cm−3[1] | ||||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Gewinnung und Darstellung
Cobaltdisulfid lässt sich direkt aus den Elementen darstellen.[3]
Es kann auch durch Einwirkung von Schwefelwasserstoff auf Cobalt(III)-komplexverbindungen gewonnen werden.
Einkristalle der Verbindung, mit einer Größe von 3 bis 4 mm und nahezu perfekten Kristallflächen, lassen sich durch eine mehrwöchige zyklische chemische Transportreaktion in einem 3-Zonen-Ofen, ausgehend von polykristallinem Cobaltdisulfid, einem geringen Schwefelzusatz sowie Chlor erhalten:[4]
Eigenschaften
Cobaltdisulfid ist ein schwarzer geruchloser nicht brennbarer Feststoff, welcher praktisch unlöslich in Wasser ist.[1] Er besitzt eine Kristallstruktur vom Pyrit-Typ (d. h. kubisches Kristallsystem, Raumgruppe Pa3 (Raumgruppen-Nr. 205), Gitterparameter a = 553,5 pm, in der Elementarzelle befinden sich vier Formeleinheiten[5]). Cobaltdisulfid enthält entsprechend zu Eisendisulfid zweiwertige Cobaltionen und das Disulfidion S22−.[6] Er wird von nichtoxidierenden Säuren oder Alkalien nicht angegriffen und beim Erhitzen unter Luftabschluss spaltet sich Schwefel ab.[3]
Unterhalb ihrer Curie-Temperatur von 124 K zeigt die Verbindung ferromagnetisches Verhalten.[4]
Verwendung
Cobaltdisulfid wird als Katalysator bei organischen Synthesen verwendet.[3]
Einzelnachweise
- Eintrag zu Cobaltdisulfid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2020. (JavaScript erforderlich)
- Cattierite (Mindat)
- Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 1667.
- R. J. Bouchard: Growth of cobalt disulfide single crystals. In: Aaron Wold and John K. Ruff (Hrsg.): Inorganic Syntheses. Band 14. McGraw-Hill Book Company, Inc., 1973, ISBN 07-071320-0 (defekt), S. 157–160 (englisch).
- Jean D'Ans, Ellen Lax: Taschenbuch für Chemiker und Physiker. 3. Elemente, anorganische Verbindungen und Materialien, Minerale, Band 3. 4. Auflage, Springer, 1997, ISBN 978-3-540-60035-0, S. 388 (eingeschränkte Vorschau in der Google-Buchsuche).
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1690.

