Nickel(II)-sulfat
Nickel(II)-sulfat ist das Nickelsalz der Schwefelsäure. Es besteht aus je einem Nickel-Kation (Ni2+) und einem Sulfat-Anion (SO42−). Beim Erhitzen über 840 °C tritt Zersetzung unter Bildung von giftigen Dämpfen (Nickelmonoxid, Schwefeltrioxid) auf. In wässriger Lösung reagiert das Nickel(II)-sulfat schwach sauer.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
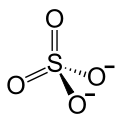 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Nickel(II)-sulfat | ||||||||||||
| Andere Namen |
Nickelsulfat | ||||||||||||
| Summenformel | NiSO4 | ||||||||||||
| Kurzbeschreibung | |||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | |||||||||||||
| Aggregatzustand |
fest | ||||||||||||
| Dichte | |||||||||||||
| Schmelzpunkt |
848 °C (Zersetzung)[2] | ||||||||||||
| Löslichkeit |
sehr gut in Wasser (650 g·l−1 bei 20 °C)[3] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Toxikologische Daten | |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Vorkommen
In der Natur kommt das Heptahydrat des Nickel(II)-sulfats als Mineral Morenosit vor.[5]
Gewinnung und Darstellung
Nickel(II)-sulfat kann durch Reaktion von Nickel, Nickel(II)-oxid oder Nickel(II)-carbonat mit verdünnter Schwefelsäure dargestellt werden.[2]
Bei der Kristallisation aus der Schwefelsäure fällt das Hexahydrat aus. Wird aus reinem Wasser kristallisiert, entsteht das Heptahydrat.
Eine Möglichkeit, das Anhydrid direkt darzustellen ist die Gasphasenreaktion von Nickeltetracarbonyl, Schwefeldioxid und Sauerstoff.[2]
Eigenschaften
-sulfate-hexahydrate-sample.jpg.webp)
Nickel(II)-sulfat existiert neben der wasserfreien Form auch als Hepta- und Hexahydrat. Das Heptahydrat liegt in Form von dunkelgrünen rhomboedrischen Kristallen vor. Beim Hexahydrat existieren zwei Modifikationen, die blaue, tetragonale α-Modifikation und das smaragdgrüne, monokline β-Nickel(II)-sulfat. Wird α-NiSO4 auf Temperaturen oberhalb von 53,3 °C erhitzt, wandelt es sich in β-NiSO4 um. Beim Erhitzen über 103 °C verlieren alle wasserhaltigen Nickelsulfate ihr Kristallwasser und werden zum kubisch kristallisierenden Anhydrid. Oberhalb von 848 °C zersetzt es sich zu Nickel(II)-oxid und Schwefeltrioxid.[2]
Verwendung
Nickel(II)-sulfat ist die technisch wichtigste Nickelverbindung. Es dient zur Herstellung von anderen Nickelverbindungen und Katalysatoren.[6] Die wässrigen Lösungen von Nickel(II)-sulfat und Nickel(II)-chlorid NiCl2 werden zur galvanischen Abscheidung von metallischen Nickelschichten verwendet. Weiterhin wird es in der Färberei als Beizmittel und bei der Herstellung von Gasmasken verwendet.
Sicherheitshinweise
Nickel(II)-sulfat ist als krebserzeugender Stoff eingestuft.[1] Hauptaufnahmeweg ist der Atemtrakt, die Resorption durch die Haut wird dagegen als vernachlässigbar angesehen. Über den Verdauungstrakt ist die Resorption stark vom Transporter abhängig: Durch gleichzeitige Nahrungsaufnahme können die Nickelionen komplexiert werden und die Aufnahmerate sinken.[1] Der Stoff kann zu Kontaktallergien führen. Nach dem Verschlucken treten Reizungen des Verdauungstrakts auf.
Einzelnachweise
- Eintrag zu Nickel(II)-sulfat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- Pradyot Patnaik: Handbook of Inorganic Chemicals. McGraw-Hill, 2003, ISBN 0-07-049439-8, S. 621–623.
- Datenblatt Nickel(II)-sulfat (PDF) bei Merck, abgerufen am 19. Januar 2011.
- Eintrag zu Nickel sulphate im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Handbook of Mineralogy: Morenosite (englisch, PDF 66,4 kB)
- Eintrag zu Nickel(II)-sulfat. In: Römpp Online. Georg Thieme Verlag, abgerufen am 5. Januar 2015.


