Nickel(II)-nitrat
Nickel(II)-nitrat ist eine chemische Verbindung des Metalls Nickel aus der Gruppe der Nitrate. Sie kommt gewöhnlich in Form ihres Hexahydrates Ni(NO3)2 · 6 H2O vor, weshalb sich alle Angaben aus der Tabelle auf dieses beziehen.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
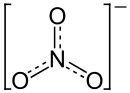 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Nickel(II)-nitrat | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel |
| ||||||||||||
| Kurzbeschreibung |
grüne, zerfließende, wasserlösliche, hygroskopische Kristalle[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | |||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||
| Dichte |
2,05 g·cm−3[1] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Siedepunkt |
136,7 °C[1] | ||||||||||||
| Löslichkeit |
sehr gut in Wasser (940 g·l−1 bei 20 °C)[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| MAK |
Schweiz: 0,05 mg·m−3 (einatembarer Staub, gemessen als Nickel)[3] | ||||||||||||
| Toxikologische Daten | |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Eigenschaften
2_hexahydrate_edit.jpg.webp)
Nickel(II)-nitrat ist ein starkes Oxidationsmittel und kommt in verschiedenen Hydratformen vor. Am häufigsten ist Hexahydrat (Ni(NO3)2 · 6 H2O). Beim langsamen Erhitzen des Nickel(II)-nitrat Hexahydrats bildet sich ab 45 °C das Tetrahydrat (Ni(NO3)2 · 4 H2O), ab 80 °C das Dihydrat (Ni(NO3)2 · 2 H2O), bei 120 bis 145 °C basisches Nickelnitrat. Beim Abkühlen kann sich das Nonahydrat bilden (Ni(NO3)2 · 9 H2O). Oberhalb von 200 °C beginnt sich Nickelnitrat zu Nickel(II)-oxid zu zersetzen. Beim raschen Erhitzen erfolgt zwischen 310 und 340 °C Zersetzung zu Nickel(II)-oxid, Stickoxiden und Sauerstoff.
Durch Reaktion von gelöstem Nickelnitrat-Hexahydrat mit Ammoniakwasser (konz.) kann bei pH>8 Hexaamminnickel(II)-nitrat gewonnen werden, ein Komplexsalz. Ähnlich kann aus Nickelnitrat-Hexahydrat und Hydrazinhydrat Nickelhydrazinnitrat gewonnen werden.
Durch Reaktion von Nickelnitrat-Lösung mit Natronlauge bzw. Natriumhydroxid entsteht hell- bis apfelgrünes Nickel(II)-hydroxid.
Verwendung
Nickel(II)-nitrat verwendet man in der Keramikindustrie (als braunes Pigment), in der Färberei als Beizmittel, zum elektrolytischen Vernickeln, zum Gewinnen von Nickel(II)-oxid und zum Herstellen von reinem Katalysatornickel.
Sicherheitshinweise
Nickel(II)-nitrat wirkt brandfördernd und ist als krebserzeugend eingestuft.
Weblinks
Einzelnachweise
- Eintrag zu Nickel(II)-nitrat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- Eintrag zu Nickel dinitrate im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach Nickelsalze, löslich), abgerufen am 4. März 2020.




