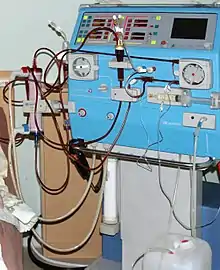
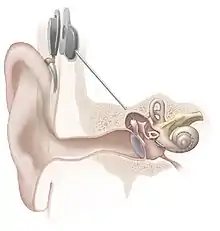
Medizintechnik
Medizintechnik, auch biomedizinische Technik oder Gesundheitstechnologie genannt, ist die Anwendung von ingenieurwissenschaftlichen Prinzipien und Regeln auf dem Gebiet der Medizin. Sie kombiniert Kenntnisse aus dem Bereich der Technik, besonders dem Lösen von Problemen und der Entwicklung, mit der medizinischen Sachkenntnis der Ärzte, der Pflegefachleute und anderer Berufe, um die Diagnostik, Therapie, Krankenpflege, Rehabilitation und Lebensqualität kranker oder auch gesunder Einzelpersonen zu verbessern. Im Englischen sind die Begriffe (bio-)medical engineering, (bio-)medical technology und health technology verbreitet.
Europäische Harmonisierung
Durch europäische Gesetzgebung ist eine Harmonisierung der nationalen Gesetzgebung vollzogen worden, welche in den einzelnen Mitgliedsländern der Europäischen Union autonom umgesetzt wird. Besonderheiten der Zuordnung zu einzelnen Gesetzeswerken bleiben national erhalten. Die Benennung der nationalen Gesetze variiert und kann über Bezugnahme auf die europäischen Regeln zugeordnet werden. Die relevanten Richtlinien und Normen umfassen folgende und weitere Richtlinien und harmonisierte Normen:[1][2][3]
- Richtlinie 90/385/EWG über aktive implantierbare medizinische Geräte
- mehrfach abgeändert
- Richtlinie 93/42/EWG über Medizinprodukte
- abgeändert durch Änderungsrichtlinie 2007/47/EG
- Richtlinie 98/79/EG über in-vitro Diagnostika
- (DIN) EN ISO 13485 – Managementsystem für Design und Herstellung von Medizinprodukten
- (DIN) EN 60601 (bzw. VDE 0750) – Normenkomplex über medizinische elektrische Geräte und Systeme
- (DIN) EN ISO 11607 über Verpackungen von Medizinprodukten
- (DIN) EN ISO 14644 über Reinräume und Reinraumbereiche
- (DIN) EN ISO 14698 über Biokontaminationkontrollen von Reinräumen und Reinraumbereichen
- (DIN) EN ISO 14971 – Herstellerseitiges Risikomanagement bei Medizinprodukten
- (DIN) EN ISO 15223-1 über Aufschriften von Medizinprodukten
Als stets mit dem medizinischen und technischen Fortschritt wachsender Bereich besteht die Aufgabe der Medizintechnik aus
- Forschung und Entwicklung (F&E), z. B. in den folgenden Bereichen:
Medizinische Informatik, Signalverarbeitung physiologischer Signale, Biomechanik, Biomaterialien und Biotechnologie, Systemanalyse, Erstellung von 3D-Modellen etc. Beispiele konkreter Anwendungen sind die Herstellung biokompatibler Prothesen, medizinischer Therapie- und Diagnosegeräte, wie z. B. EKG-Schreiber und Ultraschallgeräte, bildgebender Diagnostik, wie z. B. Magnetresonanztomographie (MRT), und Elektroenzephalographie (EEG) und der Herstellung neuer Medikamente
- Vorbereitung für die Unterstützung medizinischer Arbeit
- Vorbereitung für die Unterstützung pflegerischer Arbeit
Zukünftig werden die europäische Medizinprodukte-Verordnung (MDR – (EU) 2017/745) und die In-vitro-Diagnostika-Verordnung (IVDR – (EU) 2017/746) die bestehenden Medizinprodukte-Richtlinien und IVD-Richtlinie ablösen.
Gesetzesrahmen
Zur Abgrenzung kann beispielsweise das deutsche Medizinproduktegesetz (MPG) dienen: Medizintechnik erzeugt Geräte, Produkte und technische Verfahren, welche Medizinprodukte sind. Diese Definition reicht von einfachen Verbandsmaterialien bis zu medizinischen Großgeräten und vollständigen Anlagen. Das deutsche Medizinproduktegesetz (MPG) setzt auf nationaler Ebene die Anforderungen der europäischen Richtlinien 90/385/EWG für aktive implantierbare medizinische Geräte, 93/42/EWG für Medizinprodukte und 98/79/EG für In-vitro-Diagnostika um.
Wirtschaftliche Einordnung
Die Hersteller der Medizintechnik sind bedeutsam für die nationalen Volkswirtschaften.
Kennzeichnend für die Medizintechnik sind
- eine enge Verzahnung von Produkten und Dienstleistungen
- eine weit reichende nationale, übernationale und internationale Standardisierung
- umfängliche fortwährende Forschungs- und Entwicklungsarbeiten.
- umfassende staatliche Reglementierung zum Schutz der Patienten, der Kostenträger und der Hersteller
- vielfältig national geprägte Besonderheiten
- dem Begleitaufwand entsprechende und nicht allein aus dem Materialeinsatz bestimmte hohe Preise
Bereiche der Medizintechnik
Krankenhaustechnik

Krankenhaustechnik (englisch Clinical Engineering) ist ein Teilbereich der Medizintechnik, der sich mit medizinischen Geräten und Medizinprodukten im Krankenhaus beschäftigt. Die Aufgaben eines Ingenieurs in diesem Bereich sind die Beratung beim Erwerb und der Verwaltung von Medizinprodukten sowie das Beaufsichtigen von Medizintechnikern, um sicherzustellen, dass bei deren Tätigkeit sicherheits- und rechtliche Bestimmungen erfüllt werden. Außerdem fungieren die Ingenieure als Berater für alle Fragestellungen, die den Einsatz von Medizinprodukten betreffen. Ingenieure in diesem Bereich arbeiten eng mit der Krankenhausinformatik und medizinischen Physikern zusammen. Wenn nicht eine entsprechende Ausbildungsqualifikation vorliegt, verlangt das MPG für solch eine Tätigkeit die Qualifikation als Medizinprodukteberater.
Eine typische medizintechnische Abteilung beschäftigt sich mit der Reparatur und vorbeugenden Wartung aller Medizinprodukte, mit der Ausnahme von Geräten, die noch einer Garantie oder einem Wartungsvertrag unterliegen. Alle neuerworbenen Geräte werden zuerst auf die Erfüllung der sicherheitsrechtlichen Vorschriften untersucht, bevor sie eingesetzt werden. Dies sind z. B. Überprüfung des Ableitstromes, Überprüfung der kollisionsfreien Bewegungsabläufe bzw. der Quetschungsgefährdung, Funktion von Notaus-Tastern und gegebenenfalls Strahlungs- oder Bildqualitätsmessungen. Bei den meisten Geräten werden nicht alle Parameter einer Funktion getestet, sondern es werden sogenannte Äquivalenzklassen von Parametern gebildet, um das Testen günstiger zu machen. Trotzdem ist sichergestellt, dass die Prüfung korrekt und gewissenhaft durchgeführt wird.
Viele Medizinprodukte müssen vor ihrem Einsatz sterilisiert werden. Dies stellt ein spezielles Problem dar, da die meisten Sterilisationsverfahren Materialien und Geräte beschädigen können.
Die meisten Medizinprodukte sind entweder von sich aus sicher oder verfügen über Vorrichtungen und Systeme (Watchdogs), die einen Ausfall feststellen können und das Produkt in einen unbenutzbaren und damit sicheren Zustand überführen. Eine typische Anforderung ist die Erstfehlersicherheit. Dies bedeutet, dass kein einziger erster Fehler dazu führen kann, dass eine Nutzung des Gerätes während seiner Lebensdauer unsicher werden kann.
Medizinische Geräte
Der Verwendungszweck eines Medizinprodukts:
- Erkennung, Verhütung, Überwachung, Behandlung oder Linderung von Krankheiten;
- Erkennung, Überwachung, Behandlung, Linderung oder Kompensierung von Verletzungen oder Behinderungen;
- Untersuchung, Ersatz oder Veränderung des anatomischen Aufbaus oder eines physiologischen Vorgangs;
- Empfängnisregelung
Einige Beispiele sind Herzschrittmacher, Infusionspumpen, Herz-Lungen-Maschine, Dialysemaschinen, künstliche Organe, Sehhilfen, Cochleaimplantate, Prothesen aller Art und Zahnimplantate.
Medizinprodukte sind in verschiedene Klassen eingeteilt, bei denen aktive und passive Medizinprodukte unterschieden werden und eine weitere Unterteilung in vier Risikoklassen I, IIa, IIb und III erfolgt.
Bildgebende Diagnostik
Geräte der bildgebenden Diagnostik gehören zu den kompliziertesten Medizinprodukten in jedem Krankenhaus. Je nach darzustellendem Gewebe kommen verschiedene Verfahren mit oder ohne Kontrastmittel zum Einsatz, um strukturelle (morphologische) und/oder funktionelle (physiologische) Informationen zu erhalten. Beispiele sind:
Ohne ionisierende Strahlung:
 Ultraschallgerät
Ultraschallgerät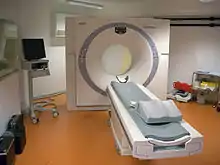 Spiral-CT
Spiral-CT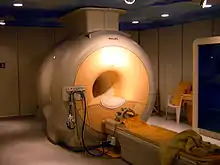 MRT
MRT PET
PET
Tissue Engineering
Eines der Ziele im Tissue Engineering ist die Erzeugung künstlicher Organe für Patienten, die eine Organtransplantation benötigen. Medizintechnik-Ingenieure erforschen gerade Methoden, solche Organe zu züchten. Beispiele für erfolgreich verpflanzte Organe sind Blasen[4]. Andere künstliche Organe, die sowohl biologische als auch synthetische Komponenten verwenden, sind auch ein Forschungsbereich, z. B. die Erzeugung von Leberersatzgeräten die Leberzellen verwenden, die in einem künstlichen Bioreaktor erzeugt wurden.[5]
Medizinische Informatik
Nach Intentionen des Gesetzgebers zählen neuerdings auch Einrichtungen der Informationstechnik zur Medizintechnik, wenn deren Funktionen bestimmend sind für Verabreichungen und Anwendungen, die den Patienten gefährden können.
Medizintechnische Industrie
Deutschland ist nach den Vereinigten Staaten und Japan der weltweit drittgrößte Produzent von Medizintechnik. Im Jahr 2012 betrug der Weltmarkt für Medizintechnik Schätzungen zufolge 331 Milliarden USD.[6] Etwa 40 % des Weltmarktes entfallen auf die USA, rund 30 % auf Europa.[7]
Die 1177 deutschen Medizintechnikhersteller erwirtschafteten im Jahr 2012 mit rund 119.000 Mitarbeitern einen Gesamtumsatz von 24,1 Milliarden Euro. Auf die 392 Betriebe mit jeweils 50 Beschäftigten und mehr entfielen davon knapp 95.000 Mitarbeiter und ein Umsatz von 22,3 Milliarden Euro (Jahr 2013: 418 Betriebe, 98.000 Beschäftigte, 22,8 Milliarden Euro Umsatz). Hinzu kommen etwa 11.460 Klein- und Handelsunternehmen sowie Vertriebsniederlassungen mit weiteren 70.000 Beschäftigten. Insgesamt sind also knapp 12.640 Medizintechnikunternehmen mit mehr als 189.000 Beschäftigten auf dem deutschen Markt tätig. Weitere 35.000 Mitarbeiter sind im Einzelhandel mit medizinischen und orthopädischen Artikeln beschäftigt. Die Branche ist stark mittelständisch geprägt: 93 % der 1177 Betriebe beschäftigen weniger als 250 Mitarbeiter. Rund 2/3 ihres Umsatzes (68 %) erwirtschaften die Unternehmen im Ausland.[8]
Im Jahr 2015 wurde von den rund 1230 deutschen Medizintechnikherstellern ein Gesamtumsatz von 27,6 Mrd. € und zudem einen Umsatzanstieg von ungefähr 9 % erwirtschaftet. Der Inlandsumsatz im Gesamtjahr 2015 hat dabei um 10 Prozent zugelegt und einen Wert von knapp 10 Milliarden Euro erreicht. Für das internationale Geschäft liegt ein Plus von fast 8 Prozent vor. Der Auslandsumsatz liegt damit bei 17,6 Milliarden Euro. Daraus ergibt sich eine Exportquote von 64 Prozent.[9]
Wichtige Interessenvertretungen der Branche in Deutschland sind die Verbände BVMed, SPECTARIS und der Fachverband für Elektromedizinische Technik des ZVEI.
Gesetzliche Bestimmungen
Gesetzliche Bestimmungen müssen auch immer im Hinterkopf eines Medizintechnik-Ingenieurs bleiben. Um Sicherheitsbestimmungen zu erfüllen, müssen die Hersteller der meisten Medizinprodukte nachweisen, dass sie den Bedingungen und Genehmigungen entsprechend geführt, entworfen, erzeugt, geprüft, geliefert und benutzt werden. Der Sinn dieser Maßnahme ist es, die Qualität und Sicherheit der Diagnostik und Therapie sicherzustellen, indem die Wahrscheinlichkeit verringert wird, versehentlich wichtige Schritte auszulassen.
In Europa wird die Entscheidung, ob ein Medizinprodukt verwendet wird, vom verschreibenden Arzt getroffen, und die bestehenden gesetzlichen Regelungen sollen sicherstellen, dass diese sowohl sicher als auch wirksam, also mehr helfen als schaden und entsprechend funktionieren. Aus diesem Grund werden Medizinprodukte von Benannten Stellen zertifiziert. Technische Komitees führender Wissenschaftler schreiben Empfehlungen, die nach Diskussion und der Einbeziehung öffentlicher Kommentare in Richtlinien (oder Verordnungen) der EU verfasst werden. Diese Richtlinien sind je nach Produkt unterschiedlich und beinhalten Vorschriften für die Entwicklung und das Testen der Sicherheit und Effektivität eines Medizinproduktes. In der EU dürfen Medizinprodukte nur in den Verkehr gebracht oder in Betrieb genommen werden, wenn diese mit einer CE-Kennzeichnung versehen sind. Die nationalen gesetzlichen Regelungen für Medizinprodukte befinden sich im Medizinprodukterecht, die sowohl in Deutschland als auch in Österreich im jeweiligen nationalen Medizinproduktegesetz (MPG), sowie in Deutschland zusätzlich in der Medizinprodukte-Betreiberverordnung (MPBetreibV) und dem Gesetz über das Mess- und Eichwesen zu finden sind.
Einige medizintechnische Geräte müssen in regelmäßigen Abständen eine Sicherheitstechnische Kontrolle (STK) und evtl. eine Messtechnische Kontrolle (MTK) unterzogen werden, dies macht meistens der Medizintechniker.
Ausbildung
Zur Planung, Entwicklung, Instandhaltung und für den Vertrieb medizinisch-technischer Produkte haben sich mehrere Berufsbilder herausgebildet. In Deutschland sind dies unter anderem der Ausbildungsberuf Medizintechniker und die Hochschulabschlüsse Dipl.-Ing. für Medizintechnik, Bachelor of Science und Master of Science in Medizintechnik.
Ausbildungsberuf Medizintechniker
Medizintechniker haben eine qualifizierte Berufsausbildung im Metall- oder Elektrobereich abgeschlossen und sich zusätzlich weiterqualifiziert. Dies kann entweder durch eine mehrjährige praktische Berufserfahrung mit medizintechnischen Geräten oder durch eine zweijährige Weiterbildung an einer Technikerschule mit dem Abschluss zum „staatlich geprüfter Techniker, (Fachrichtung) Medizintechnik“ erfolgen.
Medizintechnikstudium
In Deutschland werden die bisherigen Diplomstudiengänge in ein Bachelor-/Masterprogramm umgestellt und mit der Umstellung auf Bachelor/Masterprogramme bieten auch zunehmend Universitäten den Studiengang Medizintechnik an. Das Studium der Medizintechnik umfasst fundierte Grundlagen sowohl im Bereich Ingenieurwissenschaften als auch biologischer Wissenschaften, z. B. Physiologie, und wird daher meist mit einem Bachelor oder Master of Science abgeschlossen. Die Zahl der Hochschulen, die diesen Studiengang anbieten, wächst stark[10], da auch das Forschungsgebiet ständig wächst. Dies ist insbesondere eine Antwort auf die zunehmende Notwendigkeit der interdisziplinären Ausbildung und Forschung sowie die enorme Innovationskraft in diesem Forschungsgebiet.
An den Universitäten ist es auch weit verbreitet, dass eine Spezialisierung in Richtung Medizintechnik im Rahmen von Ingenieur- oder Physikstudiengängen angeboten wird.
Die deutsche Gesellschaft für Biomedizinische Technik (DGBMT), eine Fachgesellschaft im Verband der Elektrotechnik, Elektronik und Informationstechnik, unterteilt die Themen für das Studium der Medizintechnik folgendermaßen:[11]
- Medizinische Physik
- Medizinische Informatik
- Statistische Methoden
- Biosignalverarbeitung
- Kommunikation & Informationssysteme
- Digitale Bildverarbeitung, Computergrafik
- Biomedizinische Technik
- Klinik-Ingenieurwesen
- Biomechanik
- Biomaterialien & künstliche Organe
- Molekularbiologie, Cellular & Tissue Engineering
- Hygienetechnik
- Labor- & Analysentechnik
- Zulassung von Medizinprodukten[12]
- Gesundheitsökonomie & Ethik
- Physiologie & Anatomie
- Medizinische Terminologie
Dabei stellt die DGBMT die Themen in einem Kreis dar und ordnet sie den einzelnen Oberbegriffen mehr oder weniger exakt zu.
Seit 2014 findet mindestens einmal im Jahr die Konferenz der Medizintechnik (KOMET) als Bundesfachschaftentagung der Medizintechnik statt. An der Konferenz haben bis 2018 etwa 25 Universitäten und Fachhochschulen mindestens einmal teilgenommen.[13]
In den USA ist es häufig ein Master- oder PhD-Programm, in dem Studierende aus verschiedensten Studienfachrichtungen im Bereich Ingenieurwissenschaften oder Naturwissenschaften ihre Kenntnisse vertiefen. Aber auch als Bachelor-Programm ist es stark am Wachsen. Häufig wird es aber auch als Bachelor-Studium vor dem Beginn eines Medizinstudiums genutzt, da es den Studenten Grundlagen aus einem weiten Feld vermittelt.
Forschung
Medizintechnische Forschung kann naturwissenschaftlich-technische Grundlagenforschung sein, die mögliche Anwendbarkeit in der Medizin verspricht. Es kann sich auch um dediziert medizintechnische Grundlagenforschung handeln, um Vorlaufforschung mit eindeutigem Produktbezug oder um technische Produktentwicklung.
Die Unternehmenslandschaft ist äußerst heterogen (zwischen 1 und 10.000 Mitarbeitern, F&E-Etats zwischen 0 und 50 % des Umsatzes). Insgesamt ist die Medizintechnik aber ein Teilbereich mit überdurchschnittlich hohem Forschungsanteil. Der branchendurchschnittliche Kostenanteil für Forschung und Entwicklung ist ca. 9,5 % vom Umsatz; 14,7 % der Beschäftigten sind forschend tätig (2001). Deutsche Unternehmen halten die zweithöchste Anzahl an einschlägigen Patenten (nach US-amerikanischen Firmen) und machen 50 % ihres Umsatzes mit Produkten, die weniger als zwei Jahre lang auf dem Markt sind.
Da die Inhalte der industriellen Forschung geheim sind, beziehen sich amtliche Statistiken vorwiegend auf den öffentlichen Sektor in Hochschulen und Instituten (Fraunhofer-Gesellschaft, Max-Planck-Gesellschaft etc.). Die u. g. Bestandsaufnahme des Bundesministeriums für Forschung und Technologie (s. Weblinks) erfasst über 1100 öffentliche medizintechnische Forschungsprojekte in Deutschland. Diese haben die Schwerpunkte Informationstechnik, Bildgebende Verfahren, Biomaterialien, Zell- und Gewebetechnik. Der diesbezügliche Etat des BMFT beträgt ca. 35 Mio. € pro Jahr.
In der internationalen Literatur sind „Bildgebende Verfahren“ (MRT, Röntgen, Endoskopie) das mit weitem Abstand bedeutendste medizintechnische Forschungsgebiet. Die Bedeutung der einzelnen Länder folgt der wirtschaftlichen Situation. Deutschland hält einen Anteil von ca. 15 %, es ist insbesondere führend (mit 60 % aller Veröffentlichungen) bei den Themen „Multislice-CT“ und (mit 40 %) „Kernspintomographie“.
Kosten der Medizintechnik
Die effektiven direkten Ausgaben für die Medizintechnik werden auf 5 % der gesamten Gesundheitsausgaben geschätzt[14], nach dem Verband der Schweizer Medizintechnik Fasmed auf weniger als 5 % (Medizintechnik in der Schweiz). Pammolli et al. geben für die Schweiz 4,5 % an (2002). Gemäß dem europäischen Dachverband der Medizinprodukte-Unternehmen Eucomed sind es 6,4 % in Europa, 4,6 % in der Schweiz (1,363 Mio. €) und 5,1 % in den USA und Japan. Basys nennt für Europa 7,9 %. Nach einer anderen Studie sind es in Deutschland 10 % (Study on the value of medical devices).
Zu diesen direkten Kosten kommen allerdings die erheblichen indirekten Ausgaben und die Folgekosten in unbekanntem Ausmaß:
- Die Innovation kann für immer mehr Indikationen und Anwendungen eingesetzt werden.
- Mit der Innovation werden bisher nicht therapierbare Krankheiten behandelt.
- Bessere Möglichkeiten zur Diagnose vermehren die Anzahl an Differentialdiagnosen und sorgen so für eine angepasstere, aber auch anspruchsvollere Behandlung.
- Durch eine frühere Diagnose steigt unter Umständen die Dauer der Behandlung.
- Ausweitung des Krankheitsbegriffs.
- Die Medizintechnik erhöht die Zahl der Behandlungen aus verschiedenen Gründen: tiefere Kosten der einzelnen Behandlung, weniger Risiken und Schmerzen reduzieren die Hemmschwelle der Anwendung. Dazu kommen finanzielle Interessen der Behandler.
- Medizintechnische Innovationen können zur Lebensverlängerung und damit zu zusätzlichen Gesundheitsausgaben führen (Pammolli et al.).
Ganz abgesehen vom medizinischen Nutzen für die Patienten gibt es aber auch Einsparungen durch medizintechnische Geräte. Beispiele: raschere und bessere Diagnose, kürzere Hospitalisation und Rekonvaleszenz, kürzere Operationsdauer, weniger Arztkonsultationen (z. B. durch Telemedizin) und Pflegebedürftigkeit, geringere Arbeitsunfähigkeit und Berentung.[15] In einer Studienreihe zum Einsparpotenzial innovativer Medizintechnik konnte anhand von rund 45 Produkt- und Prozessbeispielen ein Einsparpotenzial für das deutsche Gesundheitswesen in Höhe von mehreren Milliarden Euro aufgezeigt werden.[16]
Siehe auch
- Apparatemedizin
- EN 60601, Normreihe der Medizintechnik
Literatur
- Armin Gärtner: Medizintechnik und Informationstechnologien – Bd. 2. – Bildmanagement. TÜV-Verlag, Köln 2005, ISBN 3-8249-0941-3.
- Fachzeitschrift mt – medizintechnik – Organ des VDI-Fachgebietes Medizintechnik und Organ des Fachverbandes Biomedizinische Technik. TÜV Rheinland, Köln, sechs Ausgaben jährlich, ISSN 0344-9416.
- Joan Costa-Font, Christophe Courbage, Alistair McGuire (eds): The Economics of New Health Technologies. Oxford University Press, Oxford 2009.
- Pammolli F. et al.: Medical devices – Competitiveness and impact on public health expenditure. CERM, Rome.
- Rüdiger Kramme (Hrsg.): Medizintechnik – Verfahren – Systeme – Informationsverarbeitung. 3. Auflage. Springer Verlag, Heidelberg 2007, ISBN 3-540-34102-1.
- Armin Gärtner: Medizinproduktesicherheit -Band 2 – Elektrische Sicherheit in der Medizintechnik, TÜV Media Verlag Köln 2008, ISBN 978-3-8249-1164-6
- Zauner, Schrempf: Informatik in der Medizintechnik – Grundlagen, Software, Computergestützte Systeme, Springer Verlag, WienNewYork, 2009, ISBN 978-3-211-89188-9
- Erich Wintermantel: Medizintechnik: Life Science Engineering. 5. Auflage. Springer Verlag, ISBN 978-3-540-93935-1.
Einzelnachweise
- European Commision: Harmonized Standards: Active implantable medical devices. 5. Juli 2016, abgerufen am 16. Juni 2019 (englisch).
- European Commision: Harmonized Standards: In vitro diagnostic medical devices. 5. Juli 2016, abgerufen am 16. Juni 2019 (englisch).
- European Commision: Harmonized Standards: Medical devices. 5. Juli 2016, abgerufen am 16. Juni 2019 (englisch).
- Doctors grow organs from patients' own cells, CNN, April 3, 2006
- Trial begins for first artificial liver device using human cells, University of Chicago, February 25, 1999
- Mosquera, Mary: Global Medical device market increases just 3 percent in 2012. In: Healthcare Finance News. 28. Mai 2013, abgerufen am 25. April 2014 (englisch).
- The European Medical Technology industry in Figures, MedTech Europe, Januar 2014.
- SPECTARIS-Jahrbuch 2013/2014: Die deutsche Medizintechnikindustrie
- SPECTARIS – Zahlen & Fakten – Deutscher Industrieverband für optische, medizinische und mechatronische Technologien. In: spectaris.de. Abgerufen am 28. August 2016.
- Hochschulen mit Studiengang „Medizintechnik“
- Olaf Dössel: DGBMT – Innovationen in Medizintechnik und BioEngineering. In: vde.com. DGBMT, abgerufen am 28. August 2016.
- Nach dem Medizinproduktegesetz (MPG) unterliegen Medizinprodukte einem Konformitätsbewertungsverfahren, das gleichwertig ist zur behördlichen Zulassung.
- Liste der bisherigen KOMET-Teilnehmer auf der Website der Konferenz der Medizintechnik (KOMET)
- Stella Fuhrer/Peter Frei in: Kompetenzzentrum Medizintechnik
- Gerhard Kocher: Medizintechnik. In: Gerhard Kocher, Willy Oggier (Hrsg.): Gesundheitswesen Schweiz 2010–2012 – Eine aktuelle Übersicht. 4. Auflage. Hans Huber, Bern 2010, S. 221–237
- Fachgebiet Medizintechnik TU Berlin, Droege&Comp, SPECTARIS, ZVEI: Studienreihe zum Einsparpotenzial innovativer Medizintechnik
Weblinks
- Nationale Informationsplattform Medizintechnik – Initiative BMBF
- BVMed – Bundesverband Medizintechnologie e.V. - Medizintechnik
- Nationaler Strategieprozess „Innovationen in der Medizintechnik“
- Fachverband Biomedizinische Technik e.V.
- Deutsches Institut für Medizinische Dokumentation und Information
- Zentralverband Elektrotechnik- und Elektronikindustrie e.V. - Fachverband Elektromedizinische Technik
- SPECTARIS – Deutscher Industrieverband für optische, medizinische und mechatronische Technologien e.V.
- Spitzencluster Medical Valley
- Liste aller Hochschulorte, an denen Medizintechnik studiert werden kann
- Gütegemeinschaft Medizintechnik e.V. RAL Gütezeichen Medizintechnik
- Informationen für Entwickler und Konstrukteure MED engineering