Magnesiumdiphosphat
Magnesiumdiphosphat (alternativ: Magnesiumpyrophosphat) ist das Salz von Magnesium mit der Diphosphorsäure.
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
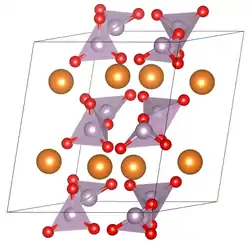 | ||||||||||||||||
| _ Mg2+ _ P5+ _ O2− | ||||||||||||||||
| Kristallsystem |
monoklin | |||||||||||||||
| Raumgruppe |
P21/c (Nr. 14) | |||||||||||||||
| Gitterparameter |
a = 13,198 Å, b = 8,259 Å, c = 13,198 Å, β = 104,9°, Z = 2 | |||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Magnesiumdiphosphat | |||||||||||||||
| Andere Namen |
Magnesiumpyrophosphat | |||||||||||||||
| Verhältnisformel | Mg2P2O7 | |||||||||||||||
| Kurzbeschreibung |
Weißer Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 222,551 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
3,14 g·cm−3 [2] | |||||||||||||||
| Schmelzpunkt |
1395±5 °C[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Darstellung
Magnesiumpyrophosphat kann durch thermische Zersetzung von Magnesiumhydrogenphosphat oder Magnesiumammoniumphosphat dargestellt werden.
Alternativ geht auch die Fällung aus wässriger Lösung, hierbei wird das Hexahydrat erhalten.[4]
Verwendung
In der Analytik wurde Magnesiumdiphosphat zur quantitativen Bestimmung von Magnesiumionen in Lösung verwendet. Alternativ kann die Verbindung auch zur gravimetrischen Bestimmung der Konzentration von Phosphorsäurelösungen genutzt werden.[5][6]
Magnesiumdiphosphat ist ein Inhibitor von Pflanzenviren und fand entsprechende industrielle Nutzung.
In der Forschung wurde die Nutzung von mit Cer oder Thorium dotiertem Magnesiumpyrophosphat als Leuchtstoff im UV-Bereich untersucht.[7][8]
Eigenschaften
Die Verbindung liegt bei Raumtemperatur in der α-Modifikation vor. Diese kristallisiert in der monoklinen Raumgruppe P21/c (Raumgruppen-Nr. 14) mit den Gitterkonstanten a = 13,198 Å, b = 8,259 Å, c = 13,198 Å und β = 104,9°. In einer Elementarzelle sind zwei Formeleinheiten.[2] Ab 68 °C findet ein Übergang in die β-Modifikation statt, welche isostrukturell zu β-Zinkpyrophosphat und Thortveitit ist. Die Raumgruppe C2/m (Raumgruppen-Nr. 12) besitzt die Dimensionen a = 6,494 Å, b = 8,28 Å, c = 4,522 Å und β = 103,8° mit Z = 2.[9] Das Dihydrat liegt in der P21/n mit den Gitterkonstanten a = 7,367 Å, b = 13,906 Å, c = 6,277 Å und β = 94,37° mit vier Einheiten pro Elementarzelle vor[10]. Das Hexahydrat kristallisiert in der Raumgruppe P21/n (Raumgruppen-Nr. 14, Stellung 2) mit den Parametern a = 7,189 Å, b = 18,309 Å, c = 7,665 Å und β = 92,360°. In einer Elementarzelle sind vier Formeleinheiten.[11][4]
Die absolute Entropie S0 beträgt 37,02±0,15 cal·mol−1·K−1, die Schmelzenthalpie ΔHfus beträgt 32,1±0,4 kcal·mol−1. Die Enthalpie des Phasenübergangs beträgt 729 cal·mol−1[3]
Einzelnachweise
- Datenblatt Magnesium pyrophosphate bei AlfaAesar, abgerufen am 25. Februar 2019 (PDF) (JavaScript erforderlich).
- Crispin Calvo: The crystal structure of α-Mg2P2O7. In: Acta Crystallographica. Band 23, 1967, S. 289–295, doi:10.1107/S0365110X67002610 (Open Access).
- F. L. Oetting, R. A. McDonald: The thermodynamic properties of magnesium orthophosphate and magnesium pyrophosphate. In: The Journal of Physical Chemistry. Band 67, Nr. 12, Dezember 1963, S. 2737–2743, doi:10.1021/j100806a055.
- Richard C. Ropp: Encyclopedia of the Alkaline Earth Compounds. Newnes, 2012, ISBN 978-0-444-59553-9, S. 266–268 (eingeschränkte Vorschau in der Google-Buchsuche [abgerufen am 25. Februar 2019]).
- Stanko Stankov Miholić: The pyrophosphate method for the determination of magnesium. In: Journal of the Chemical Society. 1930, S. 200–202, doi:10.1039/JR9300000200.
- Michael Wächter: Tabellenbuch der Chemie. Daten zur Analytik, Laborpraxis und Theorie. John Wiley & Sons, 2012, ISBN 978-3-527-32960-1, S. 78 (eingeschränkte Vorschau in der Google-Buchsuche [abgerufen am 25. Februar 2019]).
- Herman C. Froelich: Double and triple activated magnesium pyrophosphate phosphors. In: Journal of the Electrochemical Society. Band 95, Nr. 5, Mai 1949, S. 254–266, doi:10.1149/1.2776753 (psu.edu [PDF; abgerufen am 25. Februar 2019]).
- Patent US2455415A: Ultraviolet emitting magnesium pyrophosphate phosphor. Angemeldet am 15. April 1947, veröffentlicht am 7. Dezember 1948, Anmelder: General Electric, Erfinder: Herman C. Froelich.
- Crispin Calvo: Refinement of the crystal structure of β-Mg2P2O7. In: Canadian Journal of Chemistry. Band 43, Nr. 5, 1965, S. 1139–1146, doi:10.1139/v65-151.
- J. Oka, A. Kawahara: The structure of synthetic dimagnesium diphosphate(V) dihydrate. In: Acta Crystallographica. B38, S. 3–5, doi:10.1107/S0567740882001927.
- Mohamed Souhassou, Claude Lecomte, Robert H. Blessing: Crystal Chemistry of Mg2P2O7, n = 0, 2 and 6. Magnesium-Oxygen coordination and pyrophosphate ligation and conformation. In: Acta Crystallographica. B48, 1992, S. 370–376, doi:10.1107/S0108768191014313 (Open Access).
