Magnesiumanthracen
Magnesiumanthracen ist ein luft- und hydrolyseempfindlicher Magnesiumkomplex, der meist als Tetrahydrofuran-Addukt gehandhabt wird. Die Verbindung wird auch als Bogdanović-Magnesium bezeichnet.[1]
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
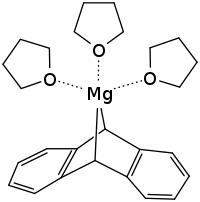 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Magnesiumanthracen | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | MgC14H10 · 3 C4H8O | |||||||||||||||
| Kurzbeschreibung |
oranges Pulver[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | ||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Geschichte
Die Erstdarstellung des Komplexes erfolgte 1965 durch Hugh E. Ramsden.[3] Ab den 1980er-Jahren begann Borislav Bogdanović am Max-Planck-Institut für Kohlenforschung in Mülheim an der Ruhr mit der systematischen Untersuchung des Komplexes.[4]
Während die Herstellung von Magnesiumhydrid aus den Elementen hohe Wasserstoffdrücke und hohe Reaktionstemperaturen von 500 °C erfordert, lässt sich Magnesiumanthracen unter milden Bedingungen leicht in Magnesiumhydrid überführen, das als ein ausgezeichneter Metallhydridspeicher mit hoher massenbezogener Wasserstoffspeicherkapazität gilt.[5]
Darstellung und Struktur
Die Synthese des luft- und wasserempfindlichen Feststoffs erfolgt durch Rühren einer metallischen Magnesiumsuspension in Anthracen, Tetrahydrofuran und Dibrommethan in einem Temperaturbereich zwischen 20 und 60 °C.[1] Dabei bildet sich ein orangefarbenes Pulver in guten Ausbeuten. Durch Waschen mit Tetrahydrofuran wird der reine Stoff erhalten. Bei höheren Temperaturen zerfällt die Verbindung wieder in die Ausgangsstoffe.[1]
Die Röntgenkristallographie zeigt ein 5-fach koordiniertes Mg-Zentrum. Der Winkel zwischen den beiden Benzo-Gruppen beträgt 72,6°.[6]
Verwendung
Die Verbindung lässt sich sowohl als Quelle für das Carbanion [C14H10]2− als auch als Quelle für hochreaktives Mg nutzen. Mit Elektrophilen wie Ketonen oder Kohlenstoffdioxid reagiert die Verbindung zu Dihydroanthracen-Derivaten der allgemeinen Formel C14H10E2. Magnesiumanthracen wird unter anderem in Solarkraftwerken dazu verwendet, um die gewonnene elektrische Energie als Magnesiumhydrid (MgH2) zu speichern.[7] Daneben ist Magnesiumanthracen eine Alternative zur Verwendung von metallischem Magnesium bei der Herstellung von Grignard-Verbindungen.[8]
Einzelnachweise
- Eintrag zu Magnesium-Anthracen. In: Römpp Online. Georg Thieme Verlag, abgerufen am 26. Dezember 2014.
- Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von Magnesiumanthracene tetrahydrofuran complex im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 14. November 2016.
- Patent US3354190: Magnesium and tin derivatives of fusedring hydrocarbons and the preparation thereof. Angemeldet am 4. Januar 1965, veröffentlicht am 21. November 1967, Anmelder: Exxon Research Engineering Co., Erfinder: Hugh E. Ramsden.
- Borislav Bogdanović: Magnesium anthracene systems and their application in synthesis and catalysis. In: Accounts of Chemical Research. 21, 1988, S. 261–267, doi:10.1021/ar00151a002.
- Borislav Bogdanovic, Shih-tsien Liao, Manfred Schwickardi, Peter Sikorsky, Bernd Spliethoff: Catalytic Synthesis of Magnesium Hydride under Mild Conditions. In: Angewandte Chemie International Edition. 19, 1980, S. 818–819, doi:10.1002/anie.198008181.
- Lutz M. Engelhardt, Stephen Harvey, Colin L. Raston, Allan H. White: Organo-magnesium reagents: the crystal structures of [Mg(anthracene)(THF)3] and [Mg(triphenylmethyl)Br(OEt2)2]. In: Journal of Organometallic Chemistry. 341, 1988, S. 39–51, doi:10.1016/0022-328X(88)89061-2.
- Sonnenenergie – Sanfter Brüter. In: DER SPIEGEL. 19. September 1988, abgerufen am 26. Dezember 2014.
- Colin L. Raston, Geoffrey Salem: Magnesium anthracene: an alternative to magnesium in the high yield synthesis of Grignard reagents. In: Journal of the Chemical Society, Chemical Communications. 1984, S. 1702, doi:10.1039/C39840001702.
