Lysidin (Nukleosid)
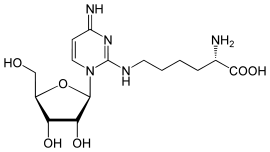
Lysidin (k2C) ist ein seltenes Nukleosid und kommt in der tRNA vor.[2] Es besteht aus der β-D-Ribofuranose (Zucker) und einem Derivat des Cytosins, wobei die Carbonylgruppe durch die Aminosäure Lysin ersetzt wurde. Dieses Substitutionsmuster hat Ähnlichkeit mit dem des Nukleosids Agmatidin.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Lysidin | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C15H25N5O6 | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 371,39 g·mol−1 | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Synthese
Lysidin und Agmatidin wurden in Mikromolmengen durch Reaktion von geschütztem Lysin oder freiem Agmatin mit S-alkylierten 2-Thiocytidin-Salzen dargestellt. Eine mehrstufige Totalsynthese ausgehend von mit Cytidin mit 4-Brombenzoyl und 2',3'-Isopropyliden-Schutz ist ebenfalls bekannt.[3]
Eigenschaften
Bakterien entschlüsseln den Isoleucin-Codon AUA mit einer tRNA, die an der dritten Position des Anticodons (Position 34) von Cytidin auf Lysidin geändert wurde. Cytidin paart sich in der Regel mit Guanosin, Lysidin paart sich dagegen nur mit Adenosin. Uridin wurde an dieser Stelle nicht eingebaut, obwohl es der übliche Partner für Adenosin ist; es kann jedoch auch ein "Wobble-Basenpaar" mit Guanosin bilden. Daher sichert Lysidin durch seine Eindeutigkeit in der Basenpaarung eine bessere Zuverlässigkeit der Translation.[4][5]
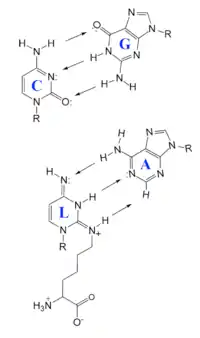 Cytidin-Guanosin-Basenpaar im Vergleich mit einem Lysidin-Adenosin-Basenpaar.
Cytidin-Guanosin-Basenpaar im Vergleich mit einem Lysidin-Adenosin-Basenpaar.
R = Ribose. Die Pfeile zeigen die Wasserstoffbrücken.
Einzelnachweise
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Patrick A. Limbach, Pamela F. Crain, James A. McCloskey: „Summary: the modified nucleosides of RNA“, Nucleic Acids Research, 1994, 22 (12), S. 2183–2196 (doi:10.1093/nar/22.12.2183, PMC 523672 (freier Volltext), PMID 7518580).
- Brett J. Kopina, Charles T. Lauhon: Efficient Preparation of 2,4-Diaminopyrimidine Nucleosides: Total Synthesis of Lysidine and Agmatidine. In: Organic Letters. Band 14, Nr. 16, 2012, ISSN 1523-7060, S. 4118–4121, doi:10.1021/ol301769j.
- K. Nakanishi, S. Fukai, Y. Ikeuchi, A. Soma, Y. Sekine, T. Suzuki, O. Nureki: „Structural basis for lysidine formation by ATP pyrophosphatase accompanied by a lysine-specific loop and a tRNA-recognition domain“, Proc. Natl. Acad. Sci. USA, 2005, 102 (21), S. 7487–7492 (doi:10.1073/pnas.0501003102, PMC 1140429 (freier Volltext), PMID 15894617).
- S. P. Salowe, J. Wiltsie, J. C. Hawkins, L. M. Sonatore: „The Catalytic Flexibility of tRNAIle-lysidine Synthetase Can Generate Alternative tRNA Substrates for Isoleucyl-tRNA Synthetase“, J. Biol. Chem., 2009, 284 (15), S. 9656–9662 (doi:10.1074/jbc.M809013200, PMC 2665086 (freier Volltext), PMID 19233850).
Weblinks
- Modification Summary von Lysidine in der Modomics-Datenbank, abgerufen am 14. Januar 2014.