Lavendamycin
Lavendamycin ist eine natürlich vorkommende chemische Verbindung, die aus der Fermentationsbrühe des Bodenbakteriums Streptomyces lavendulae isoliert werden kann.[3] Es hat antibiotische Eigenschaften und signifikante anti-proliferative Effekte gegen zahlreiche Krebs-Zelllinien.[4][5][6] Der Einsatz von Lavendamycin als Zytostatikum in der Krebstherapie scheiterte jedoch an der schlechten Wasserlöslichkeit und der unspezifischen Zytotoxizität der Verbindung.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
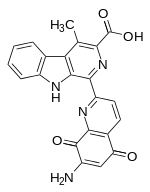 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Lavendamycin | ||||||||||||
| Summenformel | C22H14N4O4 | ||||||||||||
| Kurzbeschreibung |
dunkelrote Kristalle[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 398,37 g·mol−1 | ||||||||||||
| Schmelzpunkt |
>300 °C[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Entdeckung
Lavendamycin wurde erstmals 1981 von Doyle et al. aus Streptomyces lavendulae isoliert. Da eine Kristallisation der Verbindung nicht gelang, war eine direkte Aufklärung der Molekülstruktur durch eine Kristallstrukturanalyse nicht möglich. Durch sorgfältige Analyse mittels NMR-, IR-, UV/VIS-Spektroskopie und Massenspektrometrie konnte der Verbindung die pentacyclische Struktur, bestehend aus einer β-Carbolin- und einer Chinolinchinon-Einheit, zugeordnet werden.
Totalsynthesen
Seine attraktiven biologischen Eigenschaften und seine komplexe Struktur haben Lavendamycin zum Ziel zahlreicher Totalsynthesen gemacht.[7] Schon wenige Jahre nach der Strukturzuordnung durch Doyle et al. konnten die Forschungsgruppen von Kende,[8] Hibino,[9] Rao[10] und Boger[11] unabhängig voneinander Totalsynthesen für diesen Naturstoff entwickeln. Die Entdeckung, dass Analoge des Lavendamycins potente Inhibitoren der HIV-Reverse Transkriptase sind, führte in den 90er Jahren zu zahlreichen weiteren Versuchen, einen effizienten Zugang zu Lavendamycin zu entwickeln.[12][13][14] Viele Reaktionsschritte, geringe Gesamtausbeuten (0,5–2 %) oder schlecht verfügbare Ausgangsmaterialien machen diese Synthesen jedoch unattraktiv für eine systematische Weiterentwicklung von Lavendamycin. Hervorzuheben sind daher die Totalsynthesen von Behforouz[15] und Nissen,[16] die einen flexiblen Aufbau des Lavendamycin-Gerüsts in hohen Ausbeuten zulassen.
Einzelnachweise
- Eintrag zu Lavendamycin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 18. Juli 2011.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- T. W. Doyle, D. M. Balitz, R. E. Grulich, D. E. Nettleton, S. J. Gould, C. Tann, A. E. Moews, Tetrahedron Lett., 1981, 22, 4595–4598.
- D. M. Balitz, J. A. Bush, W. T. Bradner, T. W. Doyle, F. A. O’Herron, D. E. Nettleton, J Antibiot, 1982, 35, 259–265.
- J.-F. Riou, P. Helissey, L. Grondard, S. Giorgi-Renault, Mol. Pharmacol., 1991, 40, 699–706.
- N. Abe, Y. Nakakita, T. Nakamura, N. Enoki, H. Uchida, T. Takeo, M. Munekata, J. Antibiot., 1993, 46, 1672–1677.
- G. Bringmann, Y. Reichert, V. V. Kane, Tetrahedron, 2004, 60, 3539–3574.
- A. S. Kende, F. H. Ebetino, Tetrahedron Lett., 1984, 25, 923–926.
- S. Hibino, M. Okazaki, K. Sato, I. Morita, Heterocycles, 1983, 20, 1957–1958.
- A. V. R. Rao, S. P. Chavan, L. Sivadasan, Indian J. Chem. Sect. B, 1984, 23B, 496–497.
- D. L. Boger, S. R. Duff, J. S. Panek, M. Yasuda, J. Org. Chem., 1985, 50, 5790–5795.
- M. A. Ciufolini, M. J. Bishop, J. Chem. Soc., Chem. Commun., 1993, 1463–1464.
- Pedro Molina, Pilar M. Fresneda, Mercedes Cánovas, Tetrahedron Lett., 1992, 33, 2891–2894; b) Pedro Molina, F. Murcia, Pilar M. Fresneda, Tetrahedron Lett., 1994, 35, 1453–1456.
- P. Rocca, F. Marsais, A. Godard, G. Quéguiner, Tetrahedron Lett., 1993, 34, 2937–2940.
- M. Behforouz, Z. Gu, W. Cai, M. A. Horn, M. Ahmadian, J. Org. Chem., 1993, 58, 7089–7091.
- F. Nissen, H. Detert, Eur. J. Org. Chem., 2011, 2845–2853.