Laterale Hemmung
Als laterale Hemmung (auch Umfeldhemmung, laterale Inhibition, Lateralhemmung oder Lateralinhibition genannt) bezeichnet man in der Neurobiologie ein Verschaltungsprinzip der Nervenzellen, indem eine aktive Nervenzelle die Aktivität der benachbarten Zellen hemmt. Dieses allgemeine neurophysiologische Prinzip tritt im gesamten Zentralnervensystem auf – das am besten erforschte Beispiel ist die Erregung der Zapfen durch Tageslicht, die die Reizweiterleitung der Stäbchen hemmt.[1][2]
Verschaltungsprinzip der lateralen Hemmung
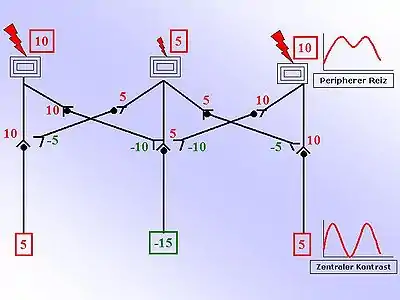
Die Zeichnung auf der rechten Seite vereinfacht das Verständnis dieses Prinzips. Zu sehen sind drei Rezeptoren, beispielsweise auf der Oberfläche der Haut. Die beiden äußeren werden stärker erregt als der innere Rezeptor. Die nebenstehenden Zahlen sind beliebige relative Einheiten, die Auskunft über die Stärke geben sollen. Je größer die Zahl, desto größer die Erregung. Positive, rote Zahlen sind erregend, negative, grüne Zahlen sind hemmend. Die Stärke der Erregung wird nun in eine Aktionspotential-Frequenz umgewandelt und weitergeleitet. Das abgebildete Verschaltungsschema zeigt inhibitorische Interneurone, die ein erregendes ankommendes Signal (Afferenz) in ein hemmendes (inhibitorisches) fortführendes Signal umwandeln. Der Switch von einer Erregung in eine Hemmung geschieht mittels unterschiedlicher Neurotransmitter (hemmend: GABA, Glycin, Adrenalin)[3]. Durch diese inhibitorischen Interneurone wird die nebenliegende Übertragung auf ein sog. zweites Neuron abgeschwächt. Diese Abschwächung erfolgt proportional zur Erregung des Interneurons (Hemmung: negative, grüne Zahlen in der Abb.) Durch einfaches Summieren der erregenden und hemmenden Einflüsse auf das zweite Neuron ergibt sich eine Kontrastverstärkung. Graphisch wird dies durch das nebenstehende Diagramm dargestellt.
Vorkommen
Sie tritt in kompliziert verflochtenen Schaltkreisen auf, wie sie beispielsweise in Ganglienzellknoten oder beim Auge in den oberen Schichten der Retina lokalisiert sind.[4]
In der Retina werden die inhibitorischen Interneurone als Horizontalzellen bezeichnet und dienen der seitlichen Verschaltung der Fotorezeptoren (Stäbchen und Zapfen).[5] Zur Verstärkung des Bildkontrastes und der raschen Erkennung von Bewegungen hat die Netzhaut jedoch noch weitere, komplexe Möglichkeiten der Verschaltung. Das Ergebnis der lateralen Hemmung ist vor allem die Kontrastverstärkung und damit die Herausbildung von Gestaltgrenzen, die als Grundlage der räumlichen Orientierung dienen können.
Laterale Hemmung in der Entwicklungsbiologie
Mit dem Begriff der lateralen Hemmung bezeichnet man auch einen Regulationsweg in der Entwicklungsbiologie. Sie wird zum Beispiel durch den Notch-Signalweg vermittelt. Da die Entwicklung von Vielzellern einen komplexen Prozess darstellt, ist das genaue Steuern von Proliferation und Spezialisierung erforderlich. Hierbei wird vermutet, dass laterale Inhibition über der den Notch-Signalweg eine wichtige Rolle spielt.[6] Bei der lateralen Inhibition wird zumeist eine binäre Entscheidung über die weitere Entwicklung einer Zelle getroffen.[7]
Hierbei sind zunächst alle Zellen vom selben "Typ", bis eine Zelle durch einen stochastischen Prozess eine Asymmetrie im Bezug auf Delta hat und mehr Delta, als alle umgebenden Zellen exprimiert. Durch eine darauf folgende positive Rückkopplung verstärkt sich diese Asymmetrie und bei den anderen Zellen wird Delta inhaliert und mehr Notch exprimiert. So werden diese Zellen zu Zellen des anderen "Typs".[8]
Dieser Prozess spielt beispielsweise bei der Ausbildung von einer exakten Struktur von Haarzellen und unterstützenden Zellen im Ohr eine Rolle. Hierbei wurde bei Hühnern nachgewiesen, dass Notch zunächst die Ausbildung von sogenannten prosensorischen Zellen initiiert und darauf hin wird durch laterale Inhibition die Menge und Verteilung der endgültigen Haarzellen reguliert.[9]
Laterale Hemmung als Inspiration für künstliche neuronale Netzwerke (maschinelles Lernen)
In sogenannten "convolutional neural networks" (CNNs) wird der Prozess der lateralen Hemmung simuliert, indem in einem Max-Pooling-Schritt innerhalb eines Layers Neuronen nach den aktivsten Neuronen selektiert werden[10], während benachbarte inaktivere Neuronen für weitere Berechnungsschritte des Netzwerkes ausgeschaltet werden.[11]
Siehe auch
Einzelnachweise
- Ashish Bakshi, Kuntal Ghosh: A Neural Model of Attention and Feedback for Computing Perceived Brightness in Vision. In: Handbook of Neural Computation. Elsevier, 2017, ISBN 978-0-12-811318-9, S. 487–513, doi:10.1016/b978-0-12-811318-9.00026-0 (elsevier.com [abgerufen am 23. Oktober 2019]).
- Friedrich Zettler, Matti Järvilehto: Lateral inhibition in an insect eye. In: Zeitschrift für Vergleichende Physiologie. Band 76, Nr. 3, 1972, ISSN 0340-7594, S. 233–244, doi:10.1007/BF00303230 (springer.com [abgerufen am 25. Oktober 2019]).
- Richard H. Kramer, Christopher M. Davenport: Lateral Inhibition in the Vertebrate Retina: The Case of the Missing Neurotransmitter. In: PLOS Biology. Band 13, Nr. 12, 10. Dezember 2015, ISSN 1545-7885, S. e1002322, doi:10.1371/journal.pbio.1002322, PMID 26656622, PMC 4675548 (freier Volltext) – (plos.org [abgerufen am 23. Oktober 2019]).
- Cameron H.G. Wright, Steven F. Barrett: Biomimetic Vision Sensors. In: Engineered Biomimicry. Elsevier, 2013, ISBN 978-0-12-415995-2, S. 1–36, doi:10.1016/b978-0-12-415995-2.00001-5 (elsevier.com [abgerufen am 23. Oktober 2019]).
- Webvision: The Organization of the Retina and Visual System. University of Utah Health Sciences Center, Salt Lake City (UT) 1995, Kap. "Simple Anatomy of the Retina", PMID 21413389 (nih.gov [abgerufen am 23. Oktober 2019]).
- Bruce Appel, Lee Anne Givan, Judith S Eisen: [No title found]. In: BMC Developmental Biology. Band 1, Nr. 1, 2001, S. 13, doi:10.1186/1471-213X-1-13, PMID 11495630, PMC 37243 (freier Volltext) – (biomedcentral.com [abgerufen am 24. Oktober 2019]).
- Makoto Sato, Tetsuo Yasugi, Yoshiaki Minami, Takashi Miura, Masaharu Nagayama: Notch-mediated lateral inhibition regulates proneural wave propagation when combined with EGF-mediated reaction diffusion. In: Proceedings of the National Academy of Sciences. Band 113, Nr. 35, 30. August 2016, ISSN 0027-8424, S. E5153–E5162, doi:10.1073/pnas.1602739113, PMID 27535937, PMC 5024646 (freier Volltext) – (pnas.org [abgerufen am 24. Oktober 2019]).
- N. Perrimon, C. Pitsouli, B.-Z. Shilo: Signaling Mechanisms Controlling Cell Fate and Embryonic Patterning. In: Cold Spring Harbor Perspectives in Biology. Band 4, Nr. 8, 1. August 2012, ISSN 1943-0264, S. a005975–a005975, doi:10.1101/cshperspect.a005975, PMID 22855721, PMC 3405863 (freier Volltext) – (cshlp.org [abgerufen am 24. Oktober 2019]).
- N. Daudet: Two contrasting roles for Notch activity in chick inner ear development: specification of prosensory patches and lateral inhibition of hair-cell differentiation. In: Development. Band 132, Nr. 3, 5. Januar 2005, ISSN 0950-1991, S. 541–551, doi:10.1242/dev.01589 (biologists.org [abgerufen am 25. Oktober 2019]).
- Cao, C., Huang, Y., Wang, Z., Wang, L., Xu, N., & Tan, T.: Lateral inhibition-inspired convolutional neural network for visual attention and saliency detection. In: Thirty-Second AAAI Conference on Artificial Intelligence. April 2018.
- Bruno Jose Torres Fernandes, George D. C. Cavalcanti, Tsang Ing Ren: Lateral Inhibition Pyramidal Neural Network for Image Classification. In: IEEE Transactions on Cybernetics. Band 43, Nr. 6, Dezember 2013, ISSN 2168-2267, S. 2082–2092, doi:10.1109/TCYB.2013.2240295 (ieee.org [abgerufen am 1. November 2019]).