Johnson-Polyen-Cyclisierung
Die Johnson-Polyen-Zyklisierung, auch biomimetische Polyen-Zyklisierung genannt, ist eine Namensreaktion der bioorganischen Chemie. Im Jahre 1968 hat William Summer Johnson das erste Mal von dieser Reaktion berichtet.[1] Generell handelt es sich hierbei um einen kationischen Prozess zur Ringbildung aus Alkenen. Diese Reaktion ermöglicht es Steroide, wie zum Beispiel Testosteron oder Cholesterin, zu synthetisieren.[2]
Übersichtsreaktion
Bei der Johnson-Polyen-Cyclisierung handelt es sich um einen kationischen Ringbildungsprozess. Als Initiatoren für die Reaktion eignen sich zum Beispiel Acetale, Allylalkohole oder Epoxide, da sie durch Protonierung leicht zu Carbeniumionen umgewandelt werden können. Diese Protonierung ermöglicht dann eine spontane Ringbildung. Im Folgenden wird beispielhaft die Reaktion eines Epoxids veranschaulicht:[2]
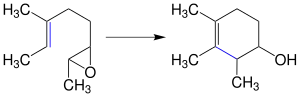
Bei der Ringbildung werden Sechsringe bevorzugt gebildet. Bei nur kurzen Reaktionszeiten, bilden sich allerdings auch Fünfringe. Außerdem werden (E)-Verbindungen bevorzugt gebildet. Für den Erfolg der Reaktion ist es wichtig das Carbokation zu stabilisieren. Zusätzlich ist ein stabiler Endzustand wichtig.[3]
Mechanismus
Der Reaktionsmechanismus wird hier nur vereinfacht dargestellt, um die generellen Vorgänge zu erläutern. Ein ausführlicher Mechanismus ist unter Anwendung zu finden.[2]

Zunächst wird die Epoxid-Gruppe protoniert. Hierzu greift ein Elektron der freien Elektronenpaare des Sauerstoffs das Wasserstoff-Atom an 1. Der Sauerstoff besitzt nun ein Elektron zu wenig, weshalb sich eine positive Partialladung bildet. Aufgrund der hohen Instabilität des positiv teilgeladenen Sauerstoffs klappt eine der Elektronenpaarbindung zum benachbarten Kohlenstoff-Atom um 2. Somit entsteht ein Carbeniumion (3). Da auch Carbeniumion nicht besonders Stabil sind, klappt die reaktive Doppelbindung um. Es bildet sich ein Sechsring-Molekül mit einer positiven Partialladung 4. Wegen dieser Ladung spaltet sich ein Proton ab und es bildet sich eine Doppelbindung. Diese lagert sich dann in den Ring um, da die Verbindung so am stabilsten ist 5. Es handelt sich hierbei um eine Wagner-Meerwein-Umlagerung.[4]
Anwendung
Mit Hilfe dieser Reaktion können Steroide synthetisiert werden. Es ist eine biomimetische Reaktion, was bedeutet, dass die Reaktion einer enzymatischen Reaktion im Körper nachempfunden ist.[2]

Das bekannteste Beispiel ist die oben aufgezeigte Synthese von Cholesterin (3) aus Squalen-2,3-epoxid (1), über das stabile Zwischenprodukt Lanosterin (2).[3] Die ersten Schritte verlaufen analog zum Reaktionsmechanismus der oben vereinfacht gezeigt ist. Die letzten beiden Schritte führen über mehrere Wagner-Meerwein-Umlagerungen zu den Produkten. In der Natur werden die beiden letzten Schritte von Enzymen durchgeführt. Hier nennt sich die Reaktion dann Squalenfaltung.[4]
Einzelnachweise
- William Summer Johnson: Nonenzymic biogenetic-like olefinic cyclizations. In: Accounts of Chemical Research. Band 1, Nr. 1, 1968, S. 1–8, doi:10.1021/ar50001a001.
- B. P. Mundy, M.G. Ellerd, F.G. Favaloro Jr.: Name Reactions & Reagents in Organic Synthesis. John Wiley & Sons, New Jersey 2005, ISBN 978-0-471-22854-7, S. 348–449.
- William S. Johnson: Biomimetic Polyene Cyclizations. In: Angewandte Chemie International Edition in English. Band 15, Nr. 1, 1976, S. 9–17, doi:10.1002/anie.197600091.
- Reinhard Brückner: Reaktionsmechanismen. Elsevier Spektrum Verlag, München 2004, ISBN 3-8274-1579-9, S. 599–602.