Java-Hufeisennase
Die Java-Hufeisennase (Rhinolophus affinis) ist eine insektenfressende Fledermausart aus der Gattung Hufeisennasen innerhalb der Familie Rhinolophidae. Sie ist im Süden und Südosten Asiens weit verbreitet und stellenweise die häufigste Fledermaus. Die Java-Hufeisennase besiedelt eine große Bandbreite natürlicher und anthropogen beeinflusster Habitate und nutzt als Ruhequartiere sowohl natürliche Höhlen, als auch Stollen und andere Strukturen. Sie gilt daher als ungefährdet.
| Java-Hufeisennase | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Java-Hufeisennase, Museumsexemplar | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Rhinolophus affinis | ||||||||||||
| Horsfield, 1823 |
Bei der Java-Hufeisennase sind gegenwärtig acht Unterarten anerkannt. Eine neunte wurde 2019 zur eigenständigen Art Rhinolophus andamanensis erhoben. Die erheblichen morphologischen Unterschiede und Abweichungen in der Frequenz der Ortungsrufe deuten darauf hin, dass die südostasiatischen Populationen der Java-Hufeisennase einen bislang nicht erkannten Artenkomplex aus mindestens drei kryptischen Arten bilden.
Die asiatischen Fledermauspopulationen sind Reservoirs zahlreicher Coronaviren. Aufgrund der genetischen Übereinstimmungen zwischen dem erstmals Ende 2019 in Wuhan aufgetretenen humanpathogenen Betacoronavirus SARS-CoV-2 und einem von der Java-Hufeisennase isolierten Virus gilt die Art als das wahrscheinliche natürliche Reservoir des Erregers von COVID-19.
Merkmale
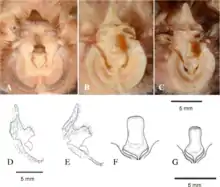
Die Java-Hufeisennase zeigt innerhalb ihres großen Verbreitungsgebiets eine große morphologische Variabilität.[1] Mit einer Kopf-Rumpf-Länge von 46 bis 68 Millimeter, einer Flügelspannweite von 290 bis 364 Millimeter und einer Unterarmlänge von 45 bis 56 Millimeter ist sie eine mittelgroße Fledermaus, etwas kleiner als die Große Hufeisennase. Sie hat deutlich kürzere Ohren (14 bis 23 Millimeter), einen kürzeren Schwanz (20 bis 30 Millimeter) und einen relativ breiteren Nasenaufsatz. Der Schädel ist mit 18,7 bis 20,5 Millimeter Unterkieferlänge kleiner und hat einen relativ deutlich kürzeren Gaumen als der Schädel der Großen Hufeisennase. Das erste Glied des dritten Fingers ist im Vergleich zur Großen Hufeisennase länger, das zweite Glied sehr lang. Die Fellfarbe variiert von gelblichbraun bis orange, wobei die Weibchen dunkler sind.[2][3][4]
Für die chinesischen Populationen wurden Kopf-Rumpf-Längen von 58 bis 63 Millimeter, Schwanzlängen von 20 bis 35 Millimeter, Fußlängen von 11 bis 13 Millimeter, Ohrenlängen von 15 bis 21 Millimeter, Unterarmlängen von 46 bis 56 Millimeter und Schädellängen von 22 bis 24 Millimeter angegeben. Die Schwanzlänge beträgt etwa das eineinhalbfache der Länge der Schienbeine. Die vierten und fünften Mittelhandknochen sind etwa gleich lang und geringfügig länger als der dritte. Die Flughäute sind lang ausgezogen.[5]
Verbreitungsgebiet
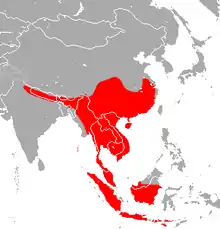
Das Verbreitungsgebiet der Java-Hufeisennase reicht im Norden vom Südrand des Himalaya mit Nepal und den nordöstlichen Bundesstaaten Indiens über Bangladesch und Südchina bis zur Pazifikküste. Im Süden sind ganz Südostasien und der Süden Borneos sowie die Großen und Kleinen Sundainseln bis einschließlich der Insel Alor besiedelt.[1]
Die Art wurde in China vom Meeresspiegel bis auf Höhen von 2000 Meter nachgewiesen.[6][5] Eine Untersuchung zur Bildung und Verbreitung der chinesischen Unterarten erbrachte das Ergebnis, dass die ursprünglich in China verbreitete Unterart Rhinolophus a. himalayanus vor etwa 800.000 Jahren vom chinesischen Festland aus in zwei separaten Ereignissen Hainan besiedelte. Dort entwickelte sich die Unterart Rhinolophus a. hainanus, die wiederum während des Bestehens einer Landbrücke auch das Festland besiedelte und sich in der darauf folgenden Isolation dort zur Unterart Rhinolophus a. macrurus entwickelte.[7] Heute werden Hainan von der Unterart Rhinolophus a. hainanus und das chinesische Festland von Rhinolophus a. himalayanus und Rhinolophus a. macrurus besiedelt.[8]
Die in älterer Literatur angegebene Verbreitung schließt die Andamanen ein, und gelegentlich wird auf Funde in Sri Lanka Bezug genommen. Die Population der Andamanen wurde 2019 als die neue Art Rhinolophus andamanensis beschrieben.[9] Über die Population auf Sri Lanka liegen keine aktuellen Daten vor, es handelt sich wahrscheinlich um eine Verwechslung oder Fehlbestimmung.[10]
Lebensweise
Die Quartiere der Java-Hufeisennase sind Höhlen oder anthropogene Strukturen wie Minen, in denen sich Kolonien von mehreren Tausend Tieren einfinden können. Dabei teilen sich beide Geschlechter die Quartiere und es finden Vergesellschaftungen mit unterschiedlichen Arten von Fledermäusen statt, auch mit der nahe verwandten Chinesischen Hufeisennase.[6][5] Im Unterschied zu vielen anderen Arten der Fledermäuse, bei denen Länge, Breite und Höhe möglicher Ruheplätze die Akzeptanz stark beeinflussen, ist die Java-Hufeisennase nicht an besonders geräumige Ruheplätze gebunden.[11] Neben Primärwäldern werden auch sekundäre Lebensräume wie Plantagen und andere landwirtschaftliche Nutzflächen besiedelt, die Städte aber gemieden.[12]
Die Java-Hufeisennase ernährt sich von Insekten, die fast ausschließlich im Flug in Bodennähe, auch im lockeren Unterholz des Waldes, erbeutet werden. Bei einer Analyse der aufgenommenen Nahrung bildeten Schmetterlinge der Familien Spanner, Trägspinner, Eulenfalter, Zünsler und andere mit mehr als 70 Prozent den größten Teil der Beute, gefolgt von etwa 20 Prozent Blatthornkäfern. Die Frequenzen der zur Echolokation ausgesendeten Schallwellen liegen zwischen 73 und 80 kHz.[13][14][5]
Über das Reproduktionsverhalten ist nur wenig bekannt. Es gibt Hinweise darauf, dass die Java-Hufeisennase polyöstrisch ist. Die Weibchen tragen nur ein einzelnes Junges.[5] In Malaysia wurden bei der Untersuchung der Populationen zweier Höhlen im April trächtige und im Juni säugende Weibchen vorgefunden. Während der Reproduktionsphase nahm die Populationsdichte in beiden Höhlen ab, um danach wieder zuzunehmen. Der Grund ist wahrscheinlich das Aufsuchen von Wochenstuben an anderen Orten durch die trächtigen Weibchen. Unklar ist, ob dieses Verhalten ein natürliches ist, oder ob die Tiere durch die häufige Anwesenheit von Touristen in den Höhlen vertrieben wurden.[15]
Viren und Parasiten
Die Java-Hufeisennase gehört unter den insgesamt nur schlecht auf ihre Parasitenfauna untersuchten Fledertieren zu den besser erforschten Arten. Eine Literaturauswertung im Jahr 2014 nannte alleine für Südostasien sechs Arten von Endoparasiten, acht Ektoparasiten und zwei Viren aus zwei Familien.[16]
Viren
Im Nachgang zur SARS-Pandemie 2002/2003, die durch das SARS-Betacoronavirus (SARS-CoV oder SARS-CoV-1) verursacht wurde, bestand der Verdacht, das Virus könne von Fledertieren auf den Menschen übertragen worden sein. Bei näheren Untersuchungen wurden zahlreiche Alphacoronaviren und Betacoronaviren in Fledermäusen verschiedener Arten nachgewiesen.[17][18] Das Wildtierreservoir von SARS-CoV-1 ist die Chinesische Hufeisennase, von der das Virus auf den Larvenroller und schließlich auf den Menschen übertragen wurde.[19][20][21]
Das Alphacoronavirus SADS-CoV (englisch Swine Acute Diarrhoea Syndrome Coronavirus), auch als HKU2-CoV bezeichnet, ist näher mit Viren der Java-Hufeisennase als mit Viren der Chinesischen Hufeisennase verwandt. Im Oktober 2016 führte es in der gleichen Region, in der auch SARS ausgebrochen ist, zum Ausbruch einer Epidemie der Durchfallerkrankung SADS in Schweinehaltungen. Die Viehseuche ist sehr ansteckend und für Ferkel mit einer sehr hohen Sterblichkeit verbunden. Isolate des Virus SADS-CoV von vier betroffenen Schweinehaltungen wiesen Unterschiede auf, die auf vier separate Übertragungen von Wildtieren auf die Schweine schließen lassen.[22] Nahe verwandte Alphacoronaviren wurden schon vor dem Ausbruch von SADS häufig in vier Arten von Hufeisennasen, darunter der Java-Hufeisennase, in Hongkong, Guangdong, Yunnan und Tibet nachgewiesen.[23]
Die häufige Vergesellschaftung mehrerer Arten von Fledertieren in Höhlen und Stollen begünstigt die Übertragung von Viren zwischen den Fledermausarten, und das ist eine Ursache für die große Diversität der Fledermaus-assoziierten Coronaviren.[24] In Südchina überschneiden sich die Verbreitungsgebiete von Chinesischer und Java-Hufeisennase. Beide Arten bewohnen gemeinsam und mit weiteren Arten von Fledertieren Höhlen und Stollen.[6][11] Von 2004 bis 2014 wurde eine Langzeituntersuchung chinesischer Fledermäuse auf Coronaviren durchgeführt. Während SARS-CoV-1, der Erreger von SARS, bei der Java-Hufeisennase eine Prävalenz von 0,5 Prozent gegenüber etwa 10 Prozent bei der Chinesischen Hufeisennase aufwies, waren es bei dem Virus HKU2, das 2016 die SADS-Epidemie auslöste, 10,5 und 1,6 Prozent.[25] Da beide Arten Reservoire einer Vielzahl einander ähnlicher Betacoronaviren sind, die andere Säugetiere einschließlich des Menschen infizieren könnten, wurde bereits Anfang 2019 die Überwachung von südchinesischen Fischmärkten, Tierfarmen und Schlachthöfen vorgeschlagen, um zukünftige Übertragungen von Zoonosen auf Haustiere und Menschen zu verhindern.[26][27]
Im Dezember 2019 kam es in Wuhan zu einem Ausbruch von COVID-19, einer SARS- und MERS-ähnlichen Infektionserkrankung der Atemwege des Menschen, die tödlich verlaufen kann. Der Erreger ist das Betacoronavirus SARS-CoV-2, das mit dem Virus RaTG13 eine Klade bildet und dessen Genom zu 96,2 Prozent mit RaTG13 übereinstimmt. RaTG13 wurde im Juli 2013 in der chinesischen Provinz Yunnan aus dem Kotabstrich einer Java-Hufeisennase isoliert.[28][29] In den Coronaviren der Fledermäuse kommt es sehr häufig zur Rekombination genetischen Materials, was die Vielgestaltigkeit dieser Viren erklärt. Die Rekombination von genetischem Material verschiedener Viren im Zuge einer Doppelinfektion mit nahe verwandten tierischen und menschlichen Krankheitserregern war in der Vergangenheit eine gängige Erklärung für das Überwinden der Artgrenzen durch zoonotische Erreger wie Influenzaviren.[30] Die Analyse des Genoms von RaTG13 zeigte jedoch, dass dieses Virus wahrscheinlich nicht aus einer Rekombination hervorgegangen ist, sondern bereits in humanpathogener Form in seinem Wildtierreservoir zirkulierte.[31] Auch die wiederholt geäußerte Ansicht, SARS-CoV-2 könne durch ein Malaiisches Schuppentier als Zwischenwirt auf den Menschen übertragen worden sein, ist eine Spekulation ohne epidemiologische Bestätigung. Schuppentiere werden in der Traditionellen Chinesischen Medizin (TCM) verwendet und in China illegal gehandelt. In der TCM werden allerdings auch Fledermäuse und ihre Ausscheidungen verwendet und auf Märkten gehandelt. So wird Fledermausguano zur Behandlung von Augenkrankheiten verwendet, und getrocknete Teile von Hufeisennasen werden in Wein oder pulverisiert zur „Entgiftung“ des Körpers verabreicht.[32]
Das Lóngquán-Virus (LQUV), ein Hantavirus aus der Gattung Loanvirus, wurde bei der Java-Hufeisennase nachgewiesen. Weitere bekannte Reservoire sind die Chinesische Hufeisennase und die japanische Art Rhinolophus monoceros.[33]
Einzeller
Die Java-Hufeisennase ist, wie viele andere insektenfressende Fledermäuse, ein Zwischenwirt des parasitischen Einzellers Toxoplasma gondii. Bei einer Untersuchung von 53 Tieren in der chinesischen Provinz Yunnan wurden vier infizierte Exemplare gefunden. Da die Toxoplasmose eine Zoonose ist, könnten die Fledermäuse als Reservoir des Parasiten für den öffentlichen Gesundheitsschutz von Bedeutung sein.[34]
Fadenwürmer
Im Blut einer bei Ruteng im Westen der indonesischen Insel Flores gefangenen männlichen Java-Hufeisennase wurden Mikrofilarien entdeckt, die als Microfilaria sundaicus Purnomo & Bangs, 1995 (Filarioidea: Onchocercidae) beschrieben wurden. Dabei ist Microfilaria Cobbold, 1882 als Sammelgattung für Arten zu verstehen, deren adulte Formen nicht bekannt sind und daher nicht beschrieben werden können. Bei der Nekropsie der zwischenzeitlich in Formalin konservierten Hufeisennase wurden keine adulten Filarien entdeckt, in der Leibeshöhle wurden aber weitere Mikrofilarien gefunden. Die Parasiten haben eine Länge von etwa 150 bis 200 und eine Breite von 5 bis 6 Mikrometer, sie ähneln äußerlich den nur von südamerikanischen Zahnarmen bekannten Mikrofilarien der Gattung Chabfilaria.[35]
Strongylacantha longicaudata (Rhabditida: Strongylacanthidae) wurde 1973 nach Exemplaren aus dem Dünndarm von Java-Hufeisennasen aus Vietnam beschrieben.[36] Die Java-Hufeisennase ist der Typuswirt des Spulwurms Monovaria rhinolophensia Khera, 1953 (Ascaridisda: Cucullanidae).[37] Macielia rhinolophi Yin, 1980 (Molineidae: Anoplostrongylinae) wurde nach einem einzigen Exemplar aus dem Dünndarm von Rhinolophus a. himalayanus beschrieben.[38] Die Art wurde wegen ihrer Herkunft und aufgrund morphologischer Merkmale 1989 als Molineus rhinolophi (Yin, 1980) und 2017 als Durettenema rhinolophi (Yin, 1980) in andere Gattungen gestellt.[39]
Plattwürmer
Der Bandwurm Vampirolepis versihamata Sawada & Harada, 1985 (Cestoda: Hymenolepididae) wurde 1985 von einer Java-Hufeisennase aus einer Kalksteinhöhle im Norden Thailands beschrieben.[40]
Kieferklauenträger
_and_I._collaris_(b%252C_habitus%253B_d%252C_gnathosoma).webp.png.webp)
_(a%252C_b)_and_I._vespertilionis_(c).webp.png.webp)
Die Java-Hufeisennase ist als einer der Wirte mehrerer Laufmilben (Trombidiformes: Trombiculidae) beschrieben worden:[41]
- Chiroptella sandoshami Nadchatram, 1966 aus China, Laos, Malaysia und Thailand;[42][43]
- Leptotrombidium deliense (Walch, 1922) aus China und Malaysia. Diese Milbe ist ein Überträger von Orientia tsutsugamushi, dem Erreger des Tsutsugamushi-Fiebers;[41]
- Rudnicula sp. aus Malaysia;[41][44]
- Trombigastia sp. aus Malaysia;[44]
- Whartonia caobangensis aus China, Malaysia und Vietnam;[41][44]
- Whartonia dewitti Nadchatram, 1980 wurde nach Funden von der Java-Hufeisennase in Malaysia und von einer weiteren Fledermausart in Thailand beschrieben (Typuswirt);[45]
- Whartonia hainana Mo, 1969 stammt von der südchinesischen Inselprovinz Hainan (Typuswirt).[46]
Die in Europa, Afrika und Asien weit verbreitete Milbe Psorergates rhinolophi Fain, 1959 (Trombidiformes: Psorergatidae) befällt neben anderen Arten der Gattung auch die Java-Hufeisennase.[47][48] Die Arten Neomybius burmensis und Neomybius orientalis (Trombidiformes: Myobiidae) wurden von dem belgischen Acarologen Alex Fain nach jeweils einem weiblichen Tier beschrieben, die beide von demselben 1906 gefangenen Museumsexemplar der Java-Hufeisennase im British Museum of Natural History stammen.[49][50]
Häufige Parasiten der Java-Hufeisennase sind Milben der Ordnung Mesostigmata: Ancystropus eonycteris, Ancystropus zeleborii, Laelaps nuttali, Laelaps sanguisugus aus Malaysia, Laelaps sculpturatus, Meristaspis lateralis, Meristaspis macroglossi, Paraperiglischrus rhinolophinus (Typuswirt), Spinturnix acuminatus, Spinturnix americanus und Spinturnix bakeri. Alle genannten Arten stammen aus Malaysia. Die große Zahl der aus Malaysia beschriebenen Arten geht auf die Arbeit des malaysischen Acarologen M. Nadchatram und seine Schüler zurück, die die Milbenfauna des Landes über Jahrzehnte intensiv studiert haben.[44]
Die Zecke Ixodes simplex wurde wiederholt bei Java-Hufeisennasen in Malaysia nachgewiesen. Eine Fledermaus trug die Nymphe einer Zecke der Gattung Dermacentor, deren Art nicht bestimmt werden konnte.[51][44] In dem südchinesischen autonomen Gebiet Guangxi wurden auf acht von 45 untersuchten Java-Hufeisennasen zehn Larven und zwei Nymphen von Schildzecken der Art Ixodes vespertilionis vorgefunden.[52] Auch in Vietnam wurde auf einer Java-Hufeisennase die Nymphe einer Zecke gefunden, die zunächst trotz morphologischer und genetischer Unterschiede als Ixodes vespertilionis identifiziert wurde.[53] 2016 wurde anhand weiterer Funde die neue Art Ixodes collaris beschrieben.[54]
Insekten

In Malaysia wurden bei Untersuchungen der Fledermausfliegen des Landes für die Java-Hufeisennase Nachweise von jeweils einer Art der Gattungen Stylidia (Diptera: Nycteribiidae) und Brachytarsina (Diptera: Streblidae) erbracht. Von der augenlosen Stylidia sp. wurden nur weibliche Exemplare entdeckt. Brachytarsina sp. wurde auf den Flughäuten der Wirte gefunden.[55] Auch in Thailand wurde bei der Java-Hufeisennase Brachytarsina sp. nachgewiesen. Darüber hinaus waren alle untersuchten Exemplare von Raymondia sp. (Diptera: Streblidae) parasitiert.[56]
Die Java-Hufeisennase ist ein Wirt der 2006 aus dem Südosten Chinas und dem Norden Vietnams beschriebenen Art Maabella stomalata (Diptera: Streblidae). Es sind bislang nur flügellose Weibchen bekannt. Die zunächst noch flugfähige Fliege sucht ihren Fledermauswirt auf und gräbt sich über den Knochen oder Gelenken der vorderen Gliedmaßen in die Flughaut ein. Dabei verliert sie ihre Flügel und Beine und kapselt sich derart ein, dass sie als eine flache, runde Struktur den Flug des Wirtes nicht beeinträchtigt und nur noch die Spitze des Hinterleibs aus einer Atemöffnung herausschaut. Gelegentlich befindet sich im Uterus einer Fliege eine einzelne Larve oder Puppe im frühen Stadium. Ob die Befruchtung vor oder nach der Besiedlung des Wirtes stattfindet, ist nicht bekannt.[57]
Systematik
Taxonomie
Die Erstbeschreibung der Java-Hufeisennase wurde 1823 von Thomas Walker Horsfield in seiner in Lieferungen erschienenen Monografie zur Zoologie Javas veröffentlicht. Der lateinische Text umfasst vier Zeilen und nennt weder Körpermaße noch andere diagnostische Merkmale, die heute zur Abgrenzung gegenüber anderen Arten der Gattung Rhinolophus herangezogen werden könnten.[58] Horsfield legte in seiner Erstbeschreibung keinen Holotypus fest, allerdings wurde ein Exemplar in der Sammlung des British Museum of Natural History als Holotypus etikettiert. Zwei weitere angebliche Typen im Nationaal Natuurhistorisch Museum in Leiden gehörten zu einer anderen von Horsfield beschriebenen Art. Das Exemplar in London wurde 2002 zum Lectotypus bestimmt.[59]
Äußere Systematik
Die Java-Hufeisennase wurde innerhalb der Gattung Hufeisennasen in die ferrumequinum-Gruppe um die auch in Mitteleuropa heimische Große Hufeisennase (Rhinolophus ferrumequinum), Rotbraune-Indien-Hufeisennase (R. rouxii) und Thomas-Hufeisennase (R. thomasi) gestellt.[12][60] Diese vorwiegend auf morphologischen Merkmalen beruhende Einteilung konnte durch eine molekulargenetische Untersuchung nicht bestätigt werden. Bei der Untersuchung von 36 Hufeisennasen aus 30 Arten wurden zwei große Kladen identifiziert, die Arten europäischer und afrikanischer Herkunft und orientalisch-asiatischer Herkunft umfassten. Die Große Hufeisennase gehört nicht in die nähere Verwandtschaft der Java-Hufeisennase, während die beiden südostasiatischen Arten Shamel-Hufeisennase (R. shameli) und Südliche Braune Hufeisennase (R. stheno) unter den untersuchten Tieren die nächsten Verwandten waren. Die Aussagekraft der Untersuchung ist allerdings gering, da auch die beiden untersuchten Java-Hufeisennasen aus Myanmar und Thailand stammten.[61]
Innere Systematik
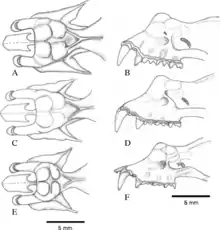
Die Java-Hufeisennase hat acht Unterarten, die sich teilweise erheblich in ihren Merkmalen unterscheiden.[62] Insgesamt sind die Unterarten aus Indien und China etwas größer als die aus Südostasien. Die Gültigkeit einiger Unterarten wird angezweifelt, was auch an der geringen Zahl untersuchter Exemplare liegt, die eine sichere Festlegung diagnostischer Merkmale und die Abgrenzung der Unterarten voneinander erschwert.[3] Die Mehrzahl der Unterarten wurde 1905 von dem dänischen Mammalogen Knud Andersen beschrieben, der im Auftrag von Oldfield Thomas vom British Museum of Natural History eine Revision der Hufeisennasen durchführte. Andersen standen dafür nicht nur die umfangreichen britischen Sammlungen zur Verfügung, sondern auch die Bestände mehrerer europäischer und US-amerikanischer Museen.[63]
- Rhinolophus a. affinis Horsfield, 1823 als Nominatform mit dem Typenfundort Java;
- Rhinolophus a. hainanus Allen, 1906 mit dem Typenfundort Pouten auf Hainan;
- Rhinolophus a. himalayanus Andersen, 1905: der Typenfundort ist Masuri im indischen Bundesstaat Uttarakhand. Die Unterart wird durchschnittlich größer und zeichnet sich gegenüber der Nominatform durch kleinere Ohren, einen schmaleren Nasenaufsatz und relativ kürzere Schienbeine und Schwänze aus;[63]
- Rhinolophus a. macrurus Andersen, 1905: aus dem nördlichen Thailand, Kambodscha, Myanmar, Laos und Vietnam, der Typenfundort ist ein Taho genannter Ort im Kayin-Staat im heutigen Myanmar. Die mittelgroße Unterart hat größere Ohren, einen breiteren Nasenaufsatz, längere Schienbeine und einen längeren Schwanz auf;[3][63]
- Rhinolophus a. nesites Andersen, 1905, der Typenfundort ist Bunguran, eine der indonesischen Natuna-Inseln. Das zur Beschreibung herangezogene Sammlungsexemplar war stark beschädigt, die Unterart scheint stark R. a. superans zu ähneln, ist aber kleiner und hat sehr kurze Schienbeine;[63]
- Rhinolophus a. princeps Andersen, 1905, Typenfundort ist Lombok, Indonesien. Die Unterart zeichnet sich durch besonders breite Hufeisen und einen im Vergleich zu den anderen Unterarten sehr breiten Schädel aus;[63]
- Rhinolophus a. superans Andersen, 1905, Typenfundort Pahang. Die Unterart ähnelt R. a. macrurus, hat aber einen kürzeren Schwanz;[63]
- Rhinolophus a. tener Andersen, 1905: der Typenfundort ist Bago, Myanmar und die Unterart zeichnet sich im Vergleich mit der Nominatform durch kleinere Körpermaße, kleinere Ohren und einen kürzeren Schwanz, aber längere Schienbeine und einen breiteren Nasenaufsatz aus.[63][64][2]
_and_holotype_(ZSI_Reg._No._15561)_(D).tif.jpg.webp)
Die 1872 von George Edward Dobson als Rhinolophus a. andamanensis beschriebene[65] Unterart der Java-Hufeisennase wurde 2019 aufgrund deutlicher morphologischer, bioakustischer und molekulargenetischer Unterschiede zur Art Rhinolophus andamanensis Dobson, 1872 erhoben.[9] 2015 veröffentlichte Forschungen legen nahe, dass es sich bei den südostasiatischen Java-Hufeisennasen um einen bislang nicht erkannten Artenkomplex aus mindestens drei kryptischen Arten handelt.[3]
Gefährdung und Schutz
Die Java-Hufeisennase erweist sich in ihrem großen Verbreitungsgebiet als sehr anpassungsfähig und besiedelt auch Lebensräume, die durch menschlichen Einfluss beeinträchtigt sind. Wo sie auftritt ist sie häufig, und bestandsgefährdende Bedrohungen sind nicht bekannt.[10][12] Die Art wurde von der IUCN 2008 als nicht gefährdet (LC – Least Concern) eingestuft. In der Volksrepublik China wurde die Art noch 2013 als gefährdet (NT – Near Threatened) betrachtet.[5] In der 2016 veröffentlichten Roten Liste der Wirbeltiere Chinas wird die Java-Hufeisennase als nicht gefährdet aufgeführt.[66]
Weblinks
- Rhinolophus affinis in der Roten Liste gefährdeter Arten der IUCN.
- Rhinolophus affinis in der Mediensammlung BioAcoustica
Einzelnachweise
- Maharadatunkamsi et al.: Genetic and morphometric diversity in Wallacea: geographical patterning in the horse shoe bat, Rhinolophus affinis. In: Journal of Biogeography. Band 27, Nr. 1, 2000, S. 193–201, doi:10.1046/j.1365-2699.2000.00381.x.
- Paul J. J. Bates et al.: A Review of Rhinolophus (Chiroptera: Rhinolophidae) from Myanmar, Including Three Species New to the Country. In: Acta Chiropterologica. Band 6, Nr. 1, 2004, S. 23–48, doi:10.3161/001.006.0103.
- Saveng Ith et al.: Taxonomic implications of geographical variation in Rhinolophus affinis (Chiroptera: Rhinolophidae) in mainland Southeast Asia. In: Zoological Studies. Band 54, 2015, 31, doi:10.1186/s40555-015-0109-8.
- Chelmala Srinivasulu, Paul A. Racey, Shahroukh Mistry: A key to the bats (Mammalia: Chiroptera) of South Asia. In: Journal of Threatened Taxa. Band 2, Nr. 7, 2010, S. 1001–1076, doi:10.11609/JoTT.o2352.1001-76.
- Don E. Wilson: Intermediate Horseshoe Bat Rhinolophus affinis. Hrsg.: Andrew T. Smith, Yan Xie. Princeton University Press, Princeton, Oxford 2013, ISBN 978-0-691-15427-5, S. 225.
- Xing-Yi Ge et al.: Coexistence of multiple coronaviruses in several bat colonies in an abandoned mineshaft. In: Virologica Sinica. Band 31, Nr. 1, 2016, S. 31–40, doi:10.1007/s12250-016-3713-9.
- Xiu Guang Mao et al.: Pleistocene climatic cycling drives intra-specific diversification in the intermediate horseshoe bat (Rhinolophus affinis) in Southern China. In: Molecular Ecology. Band 19, 2010, S. 2754–2769, doi:10.1111/j.1365-294X.2010.04704.x.
- Zhao-Min Zhou et al.: 中菊头蝠中国三亚种的形态特征比较. In: Zoological Research. Band 26, Nr. 6, 2005, S. 645–651 (chinesisch, zoores.ac.cn – englische Zusammenfassung, Morphometric Characteristics of Three Subspecies of Rhinolophus affinis in China).
- Chelmala Srinivasulu, Aditya Srinivasulu, Bhargavi Srinivasulu, Gareth Jones: Integrated Approaches to Identifying Cryptic Bat Species in Areas of High Endemism: The Case of Rhinolophus andamanensis in the Andaman Islands. In: PLoS ONE. Band 14, Nr. 10, 2019, 0213562, doi:10.1371/journal.pone.0213562.
- Sanjay Molur et al. (Hrsg.): Status of South Asian Chiroptera: Conservation Assessment and Management Plan (C.A.M.P.) Workshop Report, 2002. Zoo Outreach Organisation, CBSG South Asia, WILD, Coimbatore 2002, ISBN 81-88722-01-4 (CD-Rom).
- Niu, H. et al.: Distribution and underground habitats of cave-dwelling bats in China. In: Animal Conservation. Band 10, Nr. 4, 2007, S. 470–477, doi:10.1111/j.1469-1795.2007.00136.x.
- Rhinolophus affinis in der Roten Liste gefährdeter Arten der IUCN 2008. Eingestellt von: J. Walston, T. Kingston, A. M. Hutson, 2008. Abgerufen am 3. März 2020.
- Tinglei Jiang, Jiang Feng, Keping Sun, Jing Wang: Coexistence of two sympatric and morphologically similar bat species Rhinolophus affinis and Rhinolophus pearsoni. In: Progress in Natural Science. Band 18, Nr. 5, 2008, S. 523–532, doi:10.1016/j.pnsc.2007.12.005.
- Tinglei Jiang et al.: Coexistence of Rhinolophus affinis and Rhinolophus pearsoni revisited. In: Acta Theriologica. Band 58, 2013, S. 47–53, doi:10.1007/s13364-012-0093-x.
- Ting Jin Sia, Akbar Zubaid, Ng Yong Foo: Population trends of Rhinolophus affinis during the breeding and non-breeding season roosting at the Kota Gelanggi limestone complex, Pahang. In: AIP Conference Proceedings. Band 1678, 2015, 20033, doi:10.1063/1.4931218.
- Noellie Gay et al.: Parasite and viral species richness of Southeast Asian bats: Fragmentation of area distribution matters. In: International Journal for Parasitology: Parasites and Wildlife. Band 3, Nr. 2, 2014, S. 161–170, doi:10.1016/j.ijppaw.2014.06.003.
- Wendong Li et al.: Bats Are Natural Reservoirs of SARS-Like Coronaviruses. In: Science. Band 310, Nr. 5748, 2005, S. 676–679, doi:10.1126/science.1118391.
- Jie Cui et al.: Evolutionary Relationships between Bat Coronaviruses and Their Hosts. In: Emerging Infectious Diseases. Band 13, Nr. 10, 2007, doi:10.3201/eid1310.070448.
- Ming Wang et al.: SARS-CoV Infection in a Restaurant from Palm Civet. In: Emerging Infectious Diseases. Band 11, Nr. 12, 2005, S. 1860–1865, doi:10.3201/eid1112.041293.
- Junfa Yuan et al.: Intraspecies diversity of SARS-like coronaviruses in Rhinolophus sinicus and its implications for the origin of SARS coronaviruses in humans. In: Journal of General Virology. Band 91, Nr. 4, 2010, S. 1058–1062, doi:10.1099/vir.0.016378-0.
- Jiabao Xu et al.: Systematic Comparison of Two Animal-to-Human Transmitted Human Coronaviruses: SARS-CoV-2 and SARS-CoV. In: Viruses. Band 12, Nr. 2, 2020, 244, doi:10.3390/v12020244.
- Peng Zhou et al.: Fatal swine acute diarrhoea syndrome caused by an HKU2-related coronavirus of bat origin. In: Nature. Band 556, 2018, S. 255–258, doi:10.1038/s41586-018-0010-9.
- Yi Fan, Kai Zhao, Zheng-Li Shi, Peng Zhou: Bat Coronaviruses in China. In: Viruses. Band 11, Nr. 3, 2019, 210, doi:10.3390/v11030210.
- Ben Hu et al.: Discovery of a rich gene pool of bat SARS-related coronaviruses provides new insights into the origin of SARS coronavirus. In: PLOS Pathogens. Band 13, Nr. 11, 2017, 1006698, doi:10.1371/journal.ppat.1006698.
- Ning Wang et al.: Characterization of a New Member of Alphacoronavirus with Unique Genomic Features in Rhinolophus Bats. In: Viruses. Band 11, Nr. 4, 2019, 379, doi:10.3390/v11040379.
- Susanna K. P. Lau et al.: Novel Bat Alphacoronaviruses in Southern China Support Chinese Horseshoe Bats as an Important Reservoir for Potential Novel Coronaviruses. In: Viruses. Band 11, Nr. 2, 2019, 423, doi:10.3390/v11050423.
- Antonio C. P. Wong, Xin Li, Susanna K. P. Lau, Patrick C. Y. Woo: Global Epidemiology of Bat Coronaviruses. In: Viruses. Band 11, Nr. 2, 2019, 174, doi:10.3390/v11020174.
- Peng Zhou et al.: A pneumonia outbreak associated with a new coronavirus of probable bat origin. In: Nature. 2020, doi:10.1038/s41586-020-2012-7.
- Bat coronavirus RaTG13, complete genome. National Center for Biotechnology Information, 27. Januar 2020, abgerufen am 6. März 2020.
- Susanna K. P. Lau et al.: Ecoepidemiology and Complete Genome Comparison of Different Strains of Severe Acute Respiratory Syndrome-Related Rhinolophus Bat Coronavirus in China Reveal Bats as a Reservoir for Acute, Self-Limiting Infection That Allows Recombination Events. In: Journal of Virology. Band 84, Nr. 6, 2010, S. 2808–2819, doi:10.1128/JVI.02219-09.
- D. Paraskevis et al.: Full-genome evolutionary analysis of the novel corona virus (2019-nCoV) rejects the hypothesis of emergence as a result of a recent recombination event. In: Infection, Genetics and Evolution. Band 79, 2020, 104212, doi:10.1016/j.meegid.2020.104212.
- Trudy M. Wassenaar, Y. Zou: 2019_nCoV/SARS-CoV-2: rapid classification of betacoronaviruses and identification of Traditional Chinese Medicine as potential origin of zoonotic coronaviruses. In: Letters in Applied Microbiology. 2020, doi:10.1111/lam.13285.
- Wen-Ping Guo et al.: Phylogeny and Origins of Hantaviruses Harbored by Bats, Insectivores, and Rodents. In: PLOS Pathogens. Band 9, Nr. 2, 2013, 1003159, doi:10.1371/journal.ppat.1003159.
- H. H. Jiang et al.: Prevalence and genetic characterization of Toxoplasma gondii infection in bats in southern China. In: Veterinary Parasitology. Band 203, Nr. 3–4, 2014, S. 318–321, doi:10.1016/j.vetpar.2014.04.016.
- Purnomo, Michael J. Bangs: Microfilaria sundaicus sp. n., a Chabfilaria-lilne Parasite (Filarioidea: Onchocercidae) from the Blood of the Horseshoe Bat (Rhinolophus affinis) in Flores, Indonesia. In: Journal of the Helminthological Society of Washington. Band 62, Nr. 1, 1995, S. 32–34 (bionames.org [PDF]).
- Ferenc Mészáros: Parasitic Nematodes of Bats in Vietnam. I. In: Parasitologia Hungarica. Band 6, Nr. 6, 1973, ISSN 0303-688X, S. 149–167 (nhmus.hu).
- S. Khera: Monovaria rhinolophensia n.g., n.sp. (sub-family Seuratinae Hall, 1916: family Cucullanidae Cobbold, 1864: Nematoda) from the bat, Rhinolophus affinis. In: Indian Journal of Helminthology. Band 5, Nr. 2, 1953, S. 109–114 (nicht eingesehen).
- Wen-Zhen Yin: On the nematodes of mammals from the Dehong Area, Yunnan, China. In: Acta Zootaxonomica Sinica. Band 5, Nr. 1, 1980, ISSN 1000-0739, S. 22–29 (chinesisch, englische Zusammenfassung).
- Hui-Dong Ju, Liang Li, Lu-Ping Zhang: Durettenema guangdongense gen. et sp. nov. (Nematoda: Molineoidea) from Hipposideros larvatus (Horsfield) (Chiroptera: Rhinolophidae) with discussion of the taxonomic status of Macielia rhinolophi Yin, 1980. In: Acta Parasitologica. Band 62, Nr. 3, 2017, S. 575–581, doi:10.1515/ap-2017-0069.
- Isamu Sawada, Masashi Harada: A Survey on Bat Cestodes from Thailand with Descriptions of Six New Species. In: Zoological Science. Band 2, Nr. 2, 1985, ISSN 0289-0003, S. 271–283 (ndl.go.jp [PDF]).
- Paula Zajkowska, Hanna Moniuszko, Joanna Mąkol: Host-Parasite Associations between Bats (Mammalia: Chiroptera) and Chiggers (Trombidiformes: Trombiculidae) — A Review and Checklist. In: Annales Zoologici. Band 68, Nr. 1, 2018, S. 97–178, doi:10.3161/00034541ANZ2018.68.1.006.
- M. Nadchatram: Revision of the bat – infesting chiggers of Chiroptella Vercammen-Grandjean (Acarina: Trombiculidae), with descriptions of two new larval species and nymph. In: Journal of Medical Entomology. Band 3, Nr. 1, 1966, S. 19–28, doi:10.1093/jmedent/3.1.19.
- M. Nadchatram: A collection of chiggers from Gunong Benom (Prostigmata: Trombiculidae). In: Bulletin of the British Museum of Natural History. Zoology. Band 23, Nr. 8, 1972, S. 187–198 (Digitalisat).
- Ahamad Mariana et al.: A Survey of Acarine Ectoparasites of Bats (Chiroptera) in Malaysia. In: Journal of Medical Entomology. Band 50, Nr. 1, 2013, S. 140–146, doi:10.1603/me11240.
- M. Nadchatram: Two New Species of Old World Whartonia (Acari: Prostigmata: Trombiculidae). In: Journal of Medical Entomology. Band 17, Nr. 4, 1980, S. 324–327, doi:10.1093/jmedent/17.4.324.
- C.-F. Mo: On some parasitic mites from south China with descriptions of two new species. In: New Asia College Academy Annual. Band 11, 1969, S. 87–106 (Erstbeschreibung, nicht eingesehen).
- Alex Fain: Les Acariens psoriques parasites des Chauves-souris. III. Le Genre Psorergates Tyrrell. In: Bulletin et annales de la Société royale belge d'entomologie. Band 95, Nr. I-IV, 1959, S. 54–69 (französisch, abctaxa.be [PDF]).
- Alex Fain: Les Acariens psoriques parasites des Chauves-souris. IX. Nouvelles observations sur le genre Psorergates Tyrrell. In: Bulletin et annales de la Société royale belge d'entomologie. Band 95, Nr. VII-VIII, 1959, S. 232–248 (französisch, taxonomy.be [PDF]).
- Alex Fain: Nouveaux taxa dans la famille Myobiidae (Acarina: Trombidiformes). In: Revue de Zoologie et de Botanique africaines. Band 87, Nr. 3, 1973, S. 614–621 (französisch, chm-cbd.net [PDF]).
- Alex Fain: Notes sur les Myobiidae parasites des Rongeurs, d'Insectivores et de Chiropteres (Acarina: Prostigmata). In: Acta zoologica et pathologica Antverpiensia. Band 64, 1976, S. 3–32 (französisch, taxonomy.be [PDF]).
- Harry Hoogstraal, Boo-Liat Lim, M. Nadchatram, George Anastos: Ticks (Ixodidae) of Gunong Benom and their altitudinal distribution, hosts and medical relationships. In: Bulletin of the British Museum of Natural History. Zoology. Band 23, Nr. 7, 1972, S. 167–186 (Digitalisat).
- Sarah E. Bush, Richard G. Robbins: New host and locality records for Ixodes simplex Neumann and Ixodes vespertilionis Koch (Acari: Ixodidae) from bats (Chiroptera: Hipposideridae, Rhinolophidae and Vespertilionidae) in southern China. In: International Journal of Acarology. Band 38, Nr. 1, 2012, S. 1–5, doi:10.1080/01647954.2011.569509.
- Sándor Hornok et al.: High degree of mitochondrial gene heterogeneity in the bat tick species Ixodes vespertilionis, I. ariadnae and I. simplex from Eurasia. In: Parasites & Vectors. Band 8, 2015, 457, doi:10.1186/s13071-015-1056-2.
- Sándor Hornok, Tamás Görföl, Péter Estók, Vuong Tan Tu, Jenő Kontschán: Description of a new tick species, Ixodes collaris n. sp. (Acari: Ixodidae), from bats (Chiroptera: Hipposideridae, Rhinolophidae) in Vietnam. In: Parasites & Vectors. Band 9, 2016, 332, doi:10.1186/s13071-016-1608-0.
- Isham Azhar, Faisal Ali Anwarali Khan, Norwahidah Ismail, M. T. Abdullah: Checklist of bat flies (Diptera: Nycteribiidae and Streblidae) and their associated bat hosts in Malaysia. In: Check List. Band 11, Nr. 5, 2015, 1777, doi:10.15560/11.5.1777.
- Sarawee Aroon et al.: Ectoparasites associated with bats in tropical forest of northeastern Thailand. In: Journal of Agricultural Technology. Band 11, Nr. 8, 2015, S. 1781–1792 (aatsea.org [PDF; 282 kB]).
- Michael W. Hastriter, Sarah E. Bush: Maabella gen. nov. (Streblidae: Ascodipterinae) from Guangxi Province, China and Vietnam with notes on preservation of Ascodipterinae. In: Zootaxa. Band 1176, 2006, S. 27–40, doi:10.11646/zootaxa.1176.1.3.
- Thomas Walker Horsfield: Zoological researches in Java and the neighbouring islands. Kingsbury, Parbury and Allen, London (Digitalisat – erschienen 1821-1824, nicht paginiert).
- Gábor Csorba: Remarks on some types of the genus Rhinolophus (Mammalia, Chiroptera). In: Annales historico-naturales Musei nationalis hungarici. Band 94, 2002, S. 217–226 (nhmus.hu).
- Y. P. Sinha: Taxonomic studies on the Indian horseshoe bats of the genus Rhinolophus Lacepede. In: Mammalia. Band 37, Nr. 4, 1973, S. 603–630, doi:10.1515/mamm.1973.37.4.603.
- Samantha Stoffberg, David S. Jacobs, Iain J. Mackie, Conrad A. Matthee: Molecular phylogenetics and historical biogeography of Rhinolophus bats. In: Molecular Phylogenetics and Evolution. Band 54, Nr. 1, 2010, S. 1–9, doi:10.1016/j.ympev.2009.09.021.
- Saveng Ith et al.: Geographical variation of Rhinolophus affinis (Chiroptera: Rhinolophidae) in the Sundaic subregion of Southeast Asia, including the Malay Peninsula, Borneo and Sumatra. In: Acta Chiropterologica. Band 18, Nr. 1, 2016, S. 141–161, doi:10.3161/15081109ACC2016.18.1.006.
- Knud Andersen: On some Bats of the Genus Rhinolophus, with Remarks on their Mutual Affinities, and Descriptions of Twenty‐six new Forms. In: Proceedings of the Zoological Society of London. Band 75, Nr. 3, 1905, S. 75–144, doi:10.1111/j.1469-7998.1905.tb08381.x.
- Paul J. J. Bates, David L. Harrison: Bats of the Indian Subcontinent. Harrison Zoological Museum, Sevenoaks 1997, ISBN 0-9517313-1-9 (naturalis.nl).
- George Edward Dobson: Brief description of five new species of Rhinolophine bats. In: Journal of the Asiatic Society of Bengal. Band XLI, Nr. 4, 1872, S. 336–338 (englisch, Digitalisat).
- Zhigang Jiang et al.: Red List of China’s Vertebrates. In: Biodiversity Science. Band 24, Nr. 5, 2016, S. 500–551, doi:10.17520/biods.2016076.