Idelalisib
Idelalisib ist ein Arzneistoff, der unter dem Handelsnamen Zydelig (Hersteller: Gilead Sciences) zur Behandlung bestimmter bösartiger Erkrankungen des Lymphsystems – wie der chronischen lymphatische Leukämie (CLL) und dem follikulären Lymphom – eingesetzt wird.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
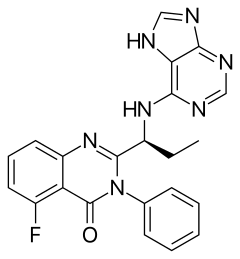 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Idelalisib | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C22H18FN7O | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
L01XX47 | |||||||||||||||||||||
| Wirkstoffklasse |
Chinazolinone | |||||||||||||||||||||
| Wirkmechanismus |
Antineoplastisch | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 415,42 g·mol−1 | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Wirkungsmechanismus
Die Substanz wirkt als Phosphoinositid-3-Kinase-Hemmer. Konkret blockiert sie P110δ, die Delta-Isoform des Enzyms Phosphoinositid-3-Kinase (PI3Kδ).[2] PI3Kδ überträgt innerhalb der Zelle Signale, die von verschiedenen Stimuli ausgelöst werden. Dazu gehören der B-Zell-Antigen-Rezeptor, Chemokin-Rezeptoren (CXCR4, CXCR5), Rezeptoren, die das Zellüberleben fördern wie der Baff-Rezeptor (BAFF-R), der Interleukin-4-Rezeptor und kostimulierende Rezeptoren wie CD40 und die Toll-like Rezeptoren (TLRs). Die PI3Kδ-Kinase wird in normalen und malignen B-Zellen exprimiert. Dementsprechend spielt PI3Kδa eine Schlüsselrolle im Überleben, in der Proliferation und in der Ausbreitung von Zellen von B-Zell-Lymphomen. Durch ihre Hemmung induziert Idelalisib die Apoptose und verhindert die Proliferation in Zelllinien, die von malignen B-Zellen abgeleitet sind, sowie in primären Tumorzellen. Außerdem beeinflusst es Trafficking und Homing von B-Zellen und Zellen von B-Lymphomen.[3][4]
Entwicklung, Studien
Idelalisib wurde von Gilead Sciences entwickelt. Die Sicherheit und Wirksamkeit von Idelalisib zur Behandlung von rezidiviertem follikulärem Lymphom (FL) und rezidiviertem kleinzelligen Lymphom (SLL) wurden in einer klinischen Studie mit 125 Teilnehmern mit langsam wachsenden (indolenten) Non-Hodgkin-Lymphomen nachgewiesen.[5] Alle Teilnehmer wurden mit Idelalisib behandelt und nach der Behandlung auf vollständiges oder teilweises Verschwinden ihres Krebses untersucht (objektive Ansprechrate, Objective Response Rate (ORR)). Die Ergebnisse zeigten, dass 54 % der Teilnehmer mit rezidiviertem FL und 58 % der Teilnehmer mit SLL eine OR erreichten.
In einer Studie mit 261 Patienten mit chronischer lymphatischer Leukämie (CLL), die nach einer vorangehenden Therapie nach weniger als 24 Monaten einen Rückfall erlitten hatten, wurde die Kombination Idelalisib plus Ofatumumab mit einer Monotherapie mit Ofatumumab verglichen. Das mediane progressionsfreie Überleben betrug 16,3 Monate in der Idelalisib-plus-Ofatumumab-Gruppe und 8,0 Monate in der Ofatumumab-Gruppe. Schwere Infektionen waren bei den Patienten mit Kombinationstherapie häufiger als bei denen mit Monotherapie.[6][7]
Zulassung/Leitlinien
Idelalisb wurde 2014 von der U.S. Food and Drug Administration (FDA) und der europäischen Kommission (EC) für die Behandlung der chronischen lymphatischen Leukämie (CLL) und des follikulären Lymphoms zugelassen.[8] Bei CLL wird Idelalisib in Kombination mit einem anderen Wirkstoff (Rituximab) bei Patienten angewendet, die mindestens eine vorangehende Therapie erhalten haben, oder bei Patienten mit genetischen Mutationen in den Krebszellen, die als 17p-Deletion oder TP53-Mutation bezeichnet werden, die keine andere Behandlung erhalten können.[9] Bei follikulärem Lymphom wird bei Patienten, deren Erkrankung auf zwei vorangehende Therapien nicht angesprochen hat, Idelalisib alleine angewendet.[10]
Unerwünschte Wirkungen
Zu den unerwünschten klinischen Symptomen einer Therapie mit Idelalisib gehören Durchfall, Fieber, Müdigkeit, Übelkeit, Husten, Lungenentzündung, Bauchschmerzen, Schüttelfrost und Hautausschlag. Zu den Laboranomalien können gehören: Neutropenie, Hypertriglyzeridämie, Hyperglykämie und erhöhte Werte von Leberenzymen. ("Transaminitis").
Die europäische und die US-Fachinformation für Idelalisib enthalt einen Warnhinweis, in dem Toxizitäten beschrieben werden, die schwerwiegend und tödlich sein können, einschließlich Lebertoxizität, schwerem Durchfall, Dickdarmentzündung (Colitis), Entzündung des Lungengewebes (Pneumonitis), Darmperforation und Progressive multifokale Leukenzephalopathie (PML), und der Hersteller wurde verpflichtet, eine Risikobewertungs- und -minderungsstrategie (REMS) einzuführen, unter der das Risiko von Toxizitäten gehandhabt werden würde.[11][12]
In den USA warnte Gilead Sciences (der Hersteller von Idelalisib) am 21. März 2016 die Fachkreise über eine verringerte Gesamtüberlebenszeit und ein erhöhtes Risiko für schwere Infektionen bei Patienten mit CLL und indolentem Non-Hodgkin-Lymphom (iNHL), die mit Idelalisib behandelt wurden. Das Unternehmen gab außerdem bekannt, dass es sechs klinische Studien bei Patienten mit CLL, SLL und iNHL aufgrund einer erhöhten Rate an unerwünschten Ereignissen, einschließlich Todesfällen, abgebrochen habe.[13]
In Europa leitete die Europäische Arzneimittelagentur im März 2016, nachdem aus drei laufenden klinischen Studien Berichte über schwerwiegende unerwünschte Ereignisse und Todesfälle, meist aufgrund von Infektionen, bekannt geworden waren, eine Überprüfung des Medikaments und seiner Risiken ein.[14] Nach Abschluss der Untersuchung empfahl sie im Juli 2016 für mit Idelalisib behandelte Patienten weitere Maßnahmen – zusätzlich zu den bereits bestehenden – zur Vorbeugung von Infektionen: Die Patienten sollten vorsorglich Antibiotika gegen durch Pneumocystis jirovecii verursachte Lungenentzündungen erhalten und die Gabe bis zu sechs Monate nach dem Absetzen von Idelalisib fortgeführt werden. Darüber hinaus werde für Patienten mit positiver CMV-Serologie zu Beginn der Behandlung mit Idelalisib oder anderen Hinweisen auf eine CMV‐Infektion in der Vorgeschichte die regelmäßige klinische und Laborüberwachung auf eine CMV-Infektion empfohlen. Zudem wurde das Anwendungsgebiet aktualisiert.[15][12] Das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) informierte im August 2016 in einen Rote-Hand-Brief über die aktualisierten Empfehlungen, die sich auch in der entsprechend überarbeiteten Fachinformation und Packungsbeilage widerspiegeln.[16]
Einzelnachweise
- Tokyo Chemical Industry Co., Ltd.(JP): Idelalisib 870281-82-6 | Tokyo Chemical Industry Co., Ltd.(JP), abgerufen am 17. Januar 2021
- John R. Somoza, David Koditek, Armando G. Villaseñor, Nikolai Novikov, Melanie H. Wong: Structural, Biochemical, and Biophysical Characterization of Idelalisib Binding to Phosphoinositide 3-Kinase δ. In: Journal of Biological Chemistry. Band 290, Nr. 13, März 2015, S. 8439–8446, doi:10.1074/jbc.M114.634683, PMID 25631052, PMC 4375495 (freier Volltext).
- DailyMed - ZYDELIG- idelalisib tablet, film coated. Abgerufen am 16. Januar 2021.
- Michael R. Gold, Kamal D. Puri: Selective inhibitors of phosphoinositide 3-kinase delta: modulators of B-cell function with potential for treating autoimmune inflammatory diseases and B-cell malignancies. In: Frontiers in Immunology. Band 3, 2012, doi:10.3389/fimmu.2012.00256, PMID 22936933, PMC 3425960 (freier Volltext).
- Ajay K. Gopal, Brad S. Kahl, Sven de Vos, Nina D. Wagner-Johnston, Stephen J. Schuster: PI3Kδ Inhibition by Idelalisib in Patients with Relapsed Indolent Lymphoma. In: New England Journal of Medicine. Band 370, Nr. 11, 13. März 2014, S. 1008–1018, doi:10.1056/NEJMoa1314583, PMID 24450858, PMC 4039496 (freier Volltext).
- Jeffrey A Jones, Tadeusz Robak, Jennifer R Brown, Farrukh T Awan, Xavier Badoux: Efficacy and safety of idelalisib in combination with ofatumumab for previously treated chronic lymphocytic leukaemia: an open-label, randomised phase 3 trial. In: The Lancet Haematology. Band 4, Nr. 3, März 2017, S. e114–e126, doi:10.1016/s2352-3026(17)30019-4.
- Jeff P. Sharman, Steven E. Coutre, Richard R. Furman, Bruce D. Cheson, John M. Pagel: Final Results of a Randomized, Phase III Study of Rituximab With or Without Idelalisib Followed by Open-Label Idelalisib in Patients With Relapsed Chronic Lymphocytic Leukemia. In: Journal of Clinical Oncology: Official Journal of the American Society of Clinical Oncology. Band 37, Nr. 16, 2019, S. 1391–1402, doi:10.1200/JCO.18.01460, PMID 30995176.
- Neues onkologisches Arzneimittel: Idelalisib (Zydelig®). Abgerufen am 16. Januar 2021.
- Leitlinienprogramm Onkologie: Chronische Lymphatische Leukämie (CLL). Abgerufen am 17. Januar 2021.
- Leitlinienprogramm Onkologie: Follikuläres Lymphom. Abgerufen am 17. Januar 2021.
- Zydelig® (idelalisib) tablets - Prescibing Information (PDF). Abgerufen am 17. Januar 2021.
- Zydelig - Zusammenfassung der Merkmale des Arzneimittels (Fachinformation). EMA, 5. November 2020, abgerufen am 17. Januar 2021.
- Center for Drug Evaluation and Research: FDA Alerts Healthcare Professionals About Clinical Trials with Zydelig (idelalisib) in Combination with other Cancer Medicines. In: FDA. 3. November 2018 (fda.gov [abgerufen am 16. Januar 2021]).
- EMA reviews cancer medicine Zydelig. Review follows concerns over serious adverse events in ongoing clinical trials. European Medicines Agency, abgerufen am 16. Januar 2021 (englisch).
- CHMP confirms recommendations for use of Zydelig. Patients should be monitored for infection and given antibiotics during and after treatment. European Medicines Agency, 3. Oktober 2016, abgerufen am 16. Januar 2021 (englisch).
- BfArM - Rote-Hand-Briefe und Informationsbriefe - Rote-Hand-Brief zu Zydelig® (Idelalisib): Aktualisierte Empfehlungen nach Abschluss der Überprüfung der Sicherheitsdaten. Abgerufen am 17. Januar 2021.