Hudsonelster
Die Hudsonelster (Pica hudsonia) ist eine Singvogelart aus der Familie der Rabenvögel. Sie ist ein typischer, 45–60 cm großer Vertreter der Echten Elstern (Pica) mit langem Schwanz und schimmernder, schwarz-weißer Gefiederzeichnung. Das Verbreitungsgebiet der Hudsonelster umfasst weite Teile des westlichen und nördlichen Nordamerika. Dort bewohnt sie offene und halboffene Landschaften mit gemäßigtem Klima. Hudsonelstern sind Allesfresser. Wirbellose, Früchte und Aas machen den Großteil der Nahrung aus, ihr jeweiliger Anteil fällt aber je nach Jahreszeit unterschiedlich aus. Die Vögel brüten von März bis Juni in monogamen Paaren und bauen auffällige, kugelförmige Nester.
| Hudsonelster | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
%252C_Parque_nacional_y_reserva_Denali%252C_Alaska%252C_Estados_Unidos%252C_2017-08-29%252C_DD_115.jpg.webp)
Hudsonelster (Pica hudsonia) im Denali-Nationalpark (Alaska) | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Pica hudsonia | ||||||||||||
| (Sabine, 1823)[1] |
Erstmals wissenschaftlich beschrieben wurde die Hudsonelster 1823 von Joseph Sabine. Lange Zeit wurde sie als Unterart der äußerlich ähnlichen Elster (Pica pica) betrachtet, von der sie sich vor allem im Sing- und Brutverhalten unterscheidet. Ihr nächster Verwandter ist die kalifornische Gelbschnabelelster (Pica nuttalli). Der Bestand der Art gilt als stabil, auch wenn es regional leichte Rückgänge gibt. Während die Elster in den indianischen Kulturen Nordamerikas ein neutrales bis positives Ansehen hatte, wurde sie von den aus Europa stammenden Siedlern bis ins 20. Jahrhundert hinein massiv verfolgt.
Merkmale
Körperbau und Farbgebung
Die Hudsonelster ist ein mittelgroßer Rabenvogel von etwa 45–60 cm Gesamtkörperlänge, dicht anliegendem Gefieder, relativ kurzen und gerundeten Flügeln sowie einem langen Schwanz. Lediglich der längere Schwanz, die etwas längeren Flügel sowie teilweise stärker blau irisierende Federn sollen sie äußerlich von der ansonsten weitgehend gleich aussehenden Elster unterscheiden.[2] Anders als diese und als eine der wenigen Arten der Familie Corvidae weist die Hudsonelster einen deutlichen Sexualdimorphismus in Bezug auf Größe und Gewicht auf. Männchen werden im Durchschnitt 6–9 % größer und 16–24 % schwerer als Weibchen. Männchen wiegen 167–216 g und haben eine Flügellänge von 205–219 mm. Ihr Schwanz wird 230–320 mm lang, ihr Schnabel misst von den Nasenlöchern bis zur Spitze 24,8–28,7 mm. Weibchen erreichen demgegenüber ein Gewicht von lediglich 141–179 g. Ihre Flügel messen 175–210, ihr Schwanz 232–300 mm. Der weibliche Schnabel wird zwischen 23,0 und 26,6 mm lang. Der Schwanz der Hudsonelster besteht aus langen, gestuften Federn mit geraden Enden. Das mittlere Steuerfederpaar ragt deutlich über den Rest des Schwanzes hinaus, bei adulten Männchen noch stärker als bei Weibchen und Jungvögeln. Zwar sind die Einzelmaße meist keine eindeutigen Bestimmungsmerkmale, miteinander kombiniert erlauben sie jedoch eine sichere Identifikation des Geschlechts. Der längliche Schnabel ist schwach gekrümmt. Über das Verbreitungsgebiet hinweg gibt es keine klinale, das heißt allmähliche Variation der Körpermaße.[3]
.jpg.webp)
Die Gefiederzeichnung der Hudsonelster entspricht dem Grundmuster der Echten Elstern. Nasalborsten, Kopf, Brust, Oberbauch und Rücken sowie Handdecken, Steuerfedern, Schenkel, Unter- und Oberschwanzdecken sind einheitlich schwarz gefärbt und irisieren blau. Die Basen der haarähnlichen Kehlfedern sind weiß, was bei geblähter Kehle sichtbar wird. Die Schulterdecken sind weiß und bilden auf dem angelegten Flügel einen markanten weißen Fleck im Gefieder. Ebenfalls weiß sind der Unterbauch und die Flanken des Körpergefieders. Die Armdecken und -schwingen, der Daumenfittich sowie die Außenfahnen, Basen und Spitzen der Handschwingen sind oberseitig tiefblau und stark blauglänzend. Unterseitig sind die entsprechenden Bereiche dagegen einheitlich schwarz und glanzlos. Die Innenfahnen der Handschwingen sind weiß, was im angelegten Flügel als schmaler weißer Streif, im Flug als große weiße Fläche sichtbar wird. Der Schwanz ist ober- wie unterseitig schwarz. Das mittlere Steuerfederpaar und die Außenfahnen der restlichen Steuerfedern glänzen metallisch blaugrün. Zum Ende hin wechselt der Glanz ins Bronzegrüne, dann ins Violette und schließlich wieder ins Blaugrüne. Die Beine sind schwarz, ebenso wie das Schnabelinnere und -äußere. Die Farbe der Iris variiert über das Jahr. Im Sommer wird sie hellbraun bis graublau, um dann gegen Winter einen dunkelbraunen Ton anzunehmen. Diese Entwicklung wiederholt sich auch bei erwachsenen Tieren jedes Jahr. Die Nickhaut ist hellblau und weist einen orangen Fleck auf.[3]
_RWD1.jpg.webp)
Jungtiere unterscheiden sich bis zur ersten Mauser in der Färbung und Morphologie in einigen Details von Altvögeln. Ihr Gefieder glänzt weniger stark als das adulter Tiere, die weißen Partien wirken durch sandfarbene Federspitzen schmutziger und die Federn sind weicher und liegen weniger stark an. Da die schwarzen Federränder im Flügel breiter sind als bei adulten Individuen, sind die weißen Partien auf den Handschwingen insgesamt kleiner. Die Schwanzfedern besitzen runde Enden und sind kürzer als bei ausgewachsenen Vögeln, die äußerste Handschwinge ist breiter und weniger sichelförmig; beide Merkmale bleiben bis zur zweiten Mauser bestehen. Im ersten Lebensjahr können Teile des Gesichts unbefiedert sein, mit der ersten Mauser ist aber dann das gesamte Gesicht befiedert. Schnabelwinkel und Schnabelinneres sind rosa, an der Spitze des Schnabels bleibt nach Verlust des Eizahns zunächst ein weißer Fleck zurück. Die Nickhaut juveniler Vögel besitzt noch keinen orangen Fleck. Es kann allerdings auch bei einigen adulten Individuen zum Wiederauftreten juveniler Merkmale (rosa Schnabelinneres, nackte Bereiche im Gesicht, weiße Schnabelspitze) kommen, die aber meist nicht so stark ausgeprägt sind wie bei den Jungtieren.[3]
Flugbild und Fortbewegung

Die Hudsonelster ist dank ihres langen Schwanzes ein überaus wendiger und agiler Flieger. Er gestattet es ihr, im Flug abrupt die Richtung zu ändern. Im Streckenflug fliegt die Hudsonelster aber, getragen von kräftigen Flügelschlägen, in relativ niedrigen Geschwindigkeiten. Sie ist in der Lage, auch noch sehr langsam geradeaus zu fliegen. Um die Fluggeschwindigkeit zu erhöhen, steigern die Vögel nicht etwa die Schlagfrequenz der Flügel, sondern bringen Körper und Schwanz stärker in die Waagrechte. Im Abwärtsflug sind oft J-förmige Flugkurven zu beobachten. Dabei legt die Hudsonelster die Flügel stark an, um 20–30 m hinabzustürzen und sich anschließend wieder zu fangen. Horizontale Hindernisse wie Hecken werden nur knapp überflogen, um dahinter abzutauchen.[4] Unter Erregung – etwa in Gegenwart eines Beutegreifers – spreizt die Hudsonelster ihre Flügel im Flug rasch zwei- oder dreimal in Folge, wodurch sich die Signalwirkung der weißen Handschwingen erhöht.[3]

Auf dem Boden schreitet die Art für gewöhnlich in einem zügigen Gang, bei dem sich der Körper ruckartig nach vorne bewegt. Der Schwanz wird dabei leicht angewinkelt, sodass er den Boden nicht berührt. Bei höheren Geschwindigkeiten wechselt die Hudsonelster wie auch die meisten anderen Rabenvögel in eine hüpfende Gangart, teilweise unterstützt von Flügelschlägen, was auch im Abflug der Vögel münden kann.[3] Wenn sie aufgeregt ist, hüpft die Hudsonelster auch seitwärts, beispielsweise um ein Objekt zu inspizieren.[4]
Lautäußerungen
In ihren Lautäußerungen ähnelt die Hudsonelster stark der Gelbschnabelelster (P. nuttalli) und unterscheidet sich deutlich von der äußerlich ähnlicheren Elster (P. pica).[5] Das Repertoire adulter Vögel besteht aus einer Reihe rauer, scharrender Rufe, von denen vor allem das schäckernde Stakkato des Alarmrufs auffällig ist. Das oft von zwei langsamen Skaa-skaa-Silben angekündigte ka-ka-ka-ka-… findet sich in sehr ähnlicher Form bei der Gelbschnabelelster. Es kann in äußerst bedrohlichen Situationen auch von einem schrillen Schrei abgelöst werden und wird nur bei direkter, meist fliegender Bedrohung geäußert. Im Falle eines am Boden herannahenden Fressfeindes hingegen verwendet die Hudsonelster ein langsameres Geschäcker. Während der Stakkato-Alarmruf zur sofortigen Flucht anderer Hudsonelstern dient, rufen die Vögel mit dem langsameren Alarmruf Artgenossen als Verstärkung herbei.[3]
Verbreitung und Wanderungen
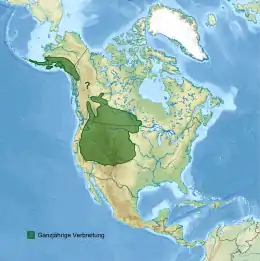
Das Verbreitungsgebiet der Hudsonelster zerfällt in ein weiträumiges Areal im westlichen Zentrum und ein kleineres Gebiet im Nordwesten des Kontinents. Das südöstliche Teilareal verläuft vom Osten British Columbias (etwa von Fraser-Fort George) südwärts parallel zur Pazifikküste. In Kanada folgt sie weitgehend dem Verlauf der Rocky Mountains, während in den Vereinigten Staaten die Kaskadenkette und die Sierra Nevada in etwa die Westgrenze bilden. Die Brutverbreitung reicht im Süden bis ins Inyo County. Von dort aus verläuft die Verbreitungsgrenze durch das südliche Nevada, den Norden von Arizona und New Mexico und den äußersten Westen Oklahomas, weiter nördlich grob entlang 100° W. Die Vorkommen werden teilweise vom Missouri River begrenzt. In North Dakota überschreitet das Artareal den Fluss etwa in Höhe von Bismarck und verläuft ostwärts bis ins nordwestliche Minnesota. Nördlich davon reicht es vom Lake of the Woods über die Seenplatte des ehemaligen Agassizsees und die Südhälfte Saskatchewans bis an den Athabasca und Peace River, fehlt aber an deren Oberläufen.[3]
Im Nordwesten reicht das Vorkommen – anders als weiter südlich – bis an die Pazifikküste. Es umfasst den äußeren Westen Alaskas bis zur Alaska-Halbinsel, die Alaskakette bildet in etwa die Nordgrenze des Teilareals. Ostwärts reicht das Verbreitungsgebiet ins südwestliche Yukon und ins nordwestliche British Columbia, erreicht aber im südlich angrenzenden Teil Alaskas nicht mehr die Festlandküste und den vorgelagerten Alexanderarchipel. Ob die Hudsonelster auch regelmäßig im Gebiet zwischen den beiden Teilarealen vorkommt, ist fraglich. Früher wurde hier eine geschlossene Verbreitung angenommen, die Brutnachweise sind hier jedoch äußerst dünn, weshalb der Status der Art in dieser Region unklar bleibt.[3]
Die heutige Verbreitung der Hudsonelster wird von Ornithologen teils auf klimatische Bedingungen, teils auf anthropogene Einflüsse zurückgeführt. Im Westen korreliert die Verbreitung mit dem kalten Trockensteppenklima, im Norden stößt sie auch in subboreale Klimata vor. Im Osten der USA verhindern möglicherweise hohe Temperaturen und Niederschläge (> 600 mm/Jahr) eine weitere Ausbreitung. Temperaturen ab 35 °C sind für die Hudsonelster – im Gegensatz zur allopatrischen Gelbschnabelelster – kritisch und werden langfristig nicht von ihr toleriert, wie in Laborstudien festgestellt wurde. Im Pleistozän reichte ihre Verbreitung bis nach Florida, Virginia, Georgia und Alabama und umfasste auch die Texas Panhandle; wahrscheinlich war sie damals im Ostteil des Kontinents ein häufiger Vogel.[6] Mit der Ausrottung des Bisons (Bison americanus) in weiten Teilen Nordamerikas verschwand auch die Hudsonelster aus diesen Regionen. Die Intensivierung der Landwirtschaft in Dakota, Nebraska und Kansas Anfang des 20. Jahrhunderts führte wohl dazu, dass die Art weiter nach Westen verdrängt wurde. In den folgenden Jahrzehnten kam es aber auch zu einer teilweisen Ausweitung der Verbreitung. Minnesota wurde zwischen 1930 und 1970 besiedelt, in Arizona ist die Hudsonelster seit 1970 wieder regelmäßiger Brutvogel. Weitflächige Rodungen in Kanada führten zu einer Ausweitung der Brutgebiete nach Norden, in Kalifornien ermöglichte wohl die eingeführte Gewöhnliche Robinie (Robinia pseudoacacia) eine Neubesiedlung im zuvor weitgehend gerodeten Owens Valley. Der Wandel der Innenstädte hin zu Parkanlagen führte in den 1960ern und 1970ern in Kanada zu einer Besiedlung urbaner Gebiete. In den westlichen Vereinigten Staaten wurde eine Urbanisierung der Art möglicherweise durch eingeführte Fuchshörnchen (Sciurus niger) verhindert, die als Nesträuber auftreten.[3]
Hudsonelstern sind tendenziell Standvögel, die das ganze Jahr über in ihrem Brutgebiet verbleiben, gewisse Wanderungstendenzen sind aber vorhanden. Jungvögel verlassen das Brutgebiet der Eltern meist im Herbst, um dann zur darauf folgenden Brutsaison zurückzukehren. In einer Studie in Idaho beobachtete Jungvogelpopulationen wanderten in höher gelegene Bergregionen, die etwa 10 km vom Nest der Eltern entfernt waren. Im Winter kommt es vor allem im Norden des Verbreitungsgebiets zu Höhenwanderungen, bei denen die Vögel in die Täler hinabziehen. In British Columbia wandert ein Teil der Population darüber hinaus auch an die wärmere Pazifikküste im Süden. Eine eruptive Invasion von 1500 Vögeln, wie sie 1919 im Death Valley beobachtet wurde, ist eine Ausnahmeerscheinung. Die Vögel können bei diesen Wanderungen teils große Distanzen zurücklegen: So legte ein Jungvogel aus Saskatchewan südostwärts 580 km zurück, weitere Rekorddistanzen liegen bei 354 und 151 km. Unregelmäßig wandern Hudsonelstern auch über die Grenzen der Brutgebiete hinaus, in der Regel aber nicht weiter östlich als Minnesota. Im Norden wurde die Art bis nach Prudhoe Bay und Banks Island gesichtet.[3]
Lebensraum

Vor allem während der Brutzeit sind Hudsonelstern auf gebüschreiche Habitate entlang von Gewässern angewiesen. Die umliegende Landschaft weist meist eine Mischung aus offenen und halboffenen Lebensräumen wie Wiesen, Grasland oder von Wüsten-Beifuß (Artemisia tridentata) durchsetztes Weideland auf. Weit weniger anspruchsvoll ist die Hudsonelster außerhalb der Brutsaison. Sie dringt dann auch in anthropogene Lebensräume ein, vor allem landwirtschaftlicher Art. Als langsamer Flieger ist die Art vor allem auf ausreichende Deckung vor Greifvögeln angewiesen und deshalb meist in der Nähe von Gebüsch, Hölzern und Waldrändern zu finden. Innerhalb von Städten nutzt die Hudsonelster neben unverbauten Uferbereichen auch Parks zur Brut. Wo vom Menschen geprägte Lebensräume nicht verfügbar sind, verbleibt sie meist in den ufernahen Bruthabitaten. Wälder und andere geschlossene Lebensräume werden gemieden und höchstens als Schlafplatz genutzt.[3]
Lebensweise
Ernährung

Hudsonelstern sind Allesfresser und ernähren sich vorwiegend von Insekten, Samen und Aas. Eine großangelegte Analyse des Mageninhalts von 569 US-amerikanischen Vögeln aus den 1920er Jahren ergab eine saisonal variierende Zusammensetzung des Nahrungsspektrums. Zwischen April und Juni bestand die Nahrung fast ausschließlich (zu 92 %) aus tierischem Material, vor allem aus Laufkäfern (Carabidae spp.), Schmetterlingsraupen (Lepidoptera spp.) und Aas. In diesen Zeitraum fällt die Hauptbrutzeit, was einen hohen Bedarf an Eiweiß mit sich bringt, gleichzeitig ist das Angebot an Insekten in dieser Zeit hoch. Zwischen Juni und November fanden sich überwiegend Springschrecken (Orthoptera spp.), Früchte und Aas in den Mägen. In den Wintermonaten von November bis März verlegten sich die Vögel stärker auf pflanzliche Nahrung (Getreide und Früchte), die etwa 60 % des Nahrungsvolumens ausmachte, ergänzt durch etwa 10 % Kleinsäuger, die vor allem im Februar und März gefressen wurden, sowie zwischen Dezember und Februar rund 30 % Aas.[7] Mit der geographischen Breite variiert die Zusammensetzung des Nahrungsspektrums. In Alberta wurde durch Gewölluntersuchungen ein pflanzlicher Anteil von 92 % der Nahrung im späten Februar festgestellt. Dabei handelte es sich vor allem um Hafer (Avena spp.) und Früchte von Prunus-Arten. Nur etwa 8 % der Gewölle enthielten hier Reste menschlichen Abfalls oder Überbleibsel von Feldmäusen (Microtus spp.).[3]

Der Großteil der Nahrung wird auf dem Boden in offener Umgebung aufgenommen. Wie alle Rabenvögel verstecken auch Hudsonelstern überschüssige Nahrung in oberflächennahen Depots. Dabei wird je nur ein Nahrungsstück pro Versteck abgelegt. Anders als bei überwiegend samenfressenden Arten werden die Verstecke aber bereits nach ein bis zwei Tagen wieder ausgehoben. Im Laufe der Zeit verlegen die Tiere die ursprünglich wahllos angelegten Verstecke in Richtung Nistplatz. Hudsonelstern beobachten sich gegenseitig aktiv bei der Nahrungssuche und beim Verstecken und lernen so nicht nur durch Zusehen, sondern räumen auch regelmäßig die Verstecke anderer Individuen aus. Vor allem Weibchen tendieren offenbar dazu, die Verstecke von Männchen auszubeuten: Männchen dominieren an Kadavern und ähnlichen Futterquellen, während Weibchen meist abseits stehen und sich dafür später die von den männlichen Vögeln versteckten Futterstücke sichern. Hirsche und Rinder tolerieren Hudsonelstern, während diese das Fell von Zecken und anderen Parasiten befreien. Zu den am häufigsten gefressenen Zecken zählen Arten der Gattungen Dermacentor, Rhipicephalus und Ixodes. Hudsonelstern wurden dabei beobachtet, Tiere bis zur Größe von Murmeltieren (Marmota sp.) zu töten. Dabei handelt es sich in der Regel um verhaltensauffällige, geschwächte Individuen, die auch eher in der Gruppe als allein erbeutet werden. Größeren Prädatoren gegenüber – etwa Rotfuchs (Vulpes vulpes) oder Weißkopfseeadler (Haliaeetus leucocephalus) – gebärden sich Hudsonelstern häufig als Kleptoparasiten. Die Vögel bilden regelmäßig 1,3–1,9 cm große Gewölle, bei deren Bildung ihnen möglicherweise das Verschlucken der Haare von Hirschen und Rindern hilft.[3]
Sozial- und Territorialverhalten

Innerhalb der Familie Corvidae gehören Hudsonelstern zu den moderat geselligen Arten. Vor allem Jungvögel finden sich das Jahr über zu größeren Schwärmen zusammen, aber auch adulte Individuen schließen sich diesen im Winter an. An gemeinsamen Schlafplätzen können sich dann mehr als 200 Tiere versammeln. Die Bildung solch großer Gruppen hat in erster Linie wohl eine soziale Funktion, indem sie zur Paarbildung, zum Lernen durch Beobachten und zum Informationsaustausch dient. Die Individualdistanz wird an diesen Schlafplätzen aber nie so weit reduziert, dass sich die Vögel gegenseitig berühren. Hudsonelstern kooperieren darüber hinaus auch beim Hassen auf potentielle Nesträuber. Dabei finden sich mehrere Brutpaare zusammen, die dem bedrohten Paar bei der Gefahrenabwehr beispringen. Anders als eurasische Elstern bilden Hudsonelstern stabile lineare, also transitive Hierarchien aus, wobei die Schnabellänge beziehungsweise die körperliche Überlegenheit bei Männchen als Indikator des Rangs gilt.[8] Außerhalb der Brutzeit ist die übliche soziale Einheit ein lockerer, kleiner Schwarm, der gemeinsam auf Nahrungssuche geht. Rangniedrige Tiere meiden die von jungen Männchen dominierten Schwärme aber und gehen allein auf Nahrungssuche. Entdecken Hudsonelstern einen toten Artgenossen, so beginnen sie laut zu schreien, um so weitere Vögel anzulocken. Diese lassen sich in der umstehenden Vegetation nieder und stimmen in das Geschrei ein. Einige Vögel fliegen zu dem Kadaver hinab, schreiten auf und ab und picken nach dem Toten, bevor nach etwa 10–15 Minuten alle Vögel die Szene wieder verlassen.[3]
Hudsonelstern sind weniger territorial als Elstern. Die Brutreviere werden nicht das ganze Jahr über verteidigt, weshalb das Ausschwärmen der Jungvögel wohl auch den Zweck hat, neue Territorien zu besetzen. Während der Brutzeit wird der Nistplatz in einem Radius von 30–50 m gegen Eindringlinge verteidigt, der Abstand zum jeweils nächsten Nest beträgt 55–300 m.[9] Bei infraspezifischen Auseinandersetzungen kommt es aufgrund der stabilen Hierarchie selten zu physischen Angriffen. Wenn ein Vogel die Rangordnung jedoch verletzt sieht, kann es zu Berührungskämpfen kommen. Beide Hudsonelstern versuchen dann laut krächzend den jeweils anderen mit den Füßen zu treten oder sich ineinander zu verkrallen, während umstehende Artgenossen die Szene mit lautstarken Rufen begleiten. Obsiegt ein Vogel, stellt er sich auf den Unterlegenen und hackt mit dem Schnabel auf ihn ein. Oft wird er dann von einem nebenstehenden Individuum abgelenkt und in ein Scheingefecht verwickelt, damit der unterlegene Artgenosse entkommen kann.[3]
Fortpflanzung und Brut
Hudsonelstern bilden monogame Brutpaare, die von unterschiedlicher Dauer sind. Sie können bis zum Tod eines Partners dauern, oft wird die Bindung zwischen den Brutpartnern aber bereits vorher gelöst. Die Geschlechtsreife setzt im ersten Lebensjahr ein, Männchen brüten aber in der Regel erst im zweiten Lebensjahr. Die Partner lernen sich meist im Winterschwarm kennen. Weibchen tendieren zu Polyandrie, was das Männchen dazu verleitet, potentielle Konkurrenten anzugreifen. Der Beginn der Brutzeit hängt vom vorhandenen Nahrungsangebot ab. Reichlich vorhandene Futterquellen verleiten Hudsonelstern dazu, früher zu brüten als sie es bei dünnem Nahrungsangebot täten.[3] Der Nestbau setzt im Süden des Verbreitungsgebiets gegen Januar/Februar ein, in nördlicheren Breiten später.[9] Beide Partner beteiligen sich am Bau. Das Weibchen übernimmt den Großteil der Feinarbeit, während sich das Männchen um die grobe Konstruktion kümmert. Das Nest besteht aus einer Schale aus sperrigen, oft dornigen Zweigen, deren Inneres mit Schlamm, feineren Haaren und Pflanzenfasern ausgekleidet wird. Über dem Nest wird eine Haube angebracht, die das Nest nach allen Seiten abschließt und ihm eine hohe, kugelige Gestalt verleiht. Möglicherweise dient diese Haube dem Schutz vor Amerikanerkrähen (C. brachyrhynchos), sie erhöht aber auch die Wärmeisolation des Nestes. Die Außenmaße betragen etwa 75 × 50 cm, können aber auch deutlich abweichen. Da neue Nester oft über alten gebaut werden, können die Nestkonstruktionen zusammen auch mehrere Meter Höhe erreichen. Die Nestmulde ist im Durchschnitt 17 cm breit und 9 cm tief. Die Neststandorte sind sehr unterschiedlich und umfassen Koniferenkronen genauso wie das Geäst von Laubbäumen und Sträuchern, zuweilen auch Strommasten. Es wird meist in einer Höhe von 1–9 m, gelegentlich auch über dem Wasser hängend platziert. Der Nestbau nimmt ein bis drei Monate in Anspruch.[3]
Nach Abschluss des Nestbaus legt das Weibchen zwischen Ende März und Anfang Juni 1–9, meist 6–7 Eier, die es rund 18 Tage lang bebrütet, während es vom Männchen versorgt wird. Die Eier messen 33,5 × 23,5 mm und sind auf olivbraunem Grund dunkelbraun gesprenkelt. Die schlüpfenden Jungen werden von beiden Eltern gefüttert und verlassen nach etwa einem Monat das Nest. Sie bleiben allerdings noch drei bis vier Wochen in der Nähe des Nestes und sind auch sechs bis acht Wochen nach dem Flüggewerden noch auf die Eltern angewiesen. Meist fliegen drei bis vier Junge pro Gelege aus. Paare mit einem älteren Männchen sind beim Nestbau erfolgreicher, ziehen mehr Junge groß und beginnen früher mit der Brut, wohingegen das Alter des Weibchens keinen Einfluss auf den Bruterfolg hat.[3]
Krankheiten und Mortalitätsursachen

Als Allesfresser ist die Hudsonelster Wirt vieler verschiedener Parasiten, vor allem von Fadenwürmern, Saugwürmern und Bandwürmern. Es wird angenommen, dass fast alle adulten Elstern von Endoparasiten befallen sind. Die Federlinge Docophorous communis und Myrsidea eurysternum sind die häufigsten Ektoparasiten. Hinzu kommen eine Reihe von Zecken und Fliegen, die vor allem Nestlinge befallen.[3]
In den ersten Lebenstagen verhungern viele Nestlinge, Greifvögel, Eulen sowie Raben und Krähen tragen darüber hinaus zum Tod vieler Jungvögel bei. Habicht (Accipiter gentilis), Virginia-Uhu (Bubo virginianus) und große Falkenarten (Falco spp.) gehören zu den Hauptfeinden ausgewachsener Vögel. Daneben fallen viele Hudsonelstern vor allem in Kanada noch immer der Verfolgung durch den Menschen zum Opfer.[3]
Systematik und Forschungsgeschichte

Die Hudsonelster wurde 1823 von Joseph Sabine als „Corvus Hudsonius“ im Forschungsbericht der Coppermine-Expedition John Franklins erstbeschrieben. Das Artepitheton hudsonia nimmt auf die Hudson Bay Bezug, von wo das Typusexemplar der Beschreibung offenbar stammte. Sabine ging irrtümlich davon aus, dass sowohl die Hudsonelster als auch die Elster (P. pica) Nordamerika bewohnten und sich die Hudsonelster äußerlich nicht nur durch ihre Maße, sondern auch durch ein Federbüschel am Rücken unterscheidet.[1] Lange Zeit wurde sie als konspezifisch mit der sehr ähnlichen Elster betrachtet, bevor Studien über ihre Lautäußerungen und ihre Brutgewohnheiten von Tim Birkhead[5][10] und Derek Goodwin[11] eine nähere Verwandtschaft zur Gelbschnabelelster (P. nuttalli) nahelegten. DNA-Untersuchungen bestätigten diese Vermutung schließlich. Birkhead trug auch maßgeblich zur Erforschung des Verhaltens der Art bei, Charles H. Trost verfasste eine Monografie für die Birds of North America.[3]
| |||||||||||||||||||||
| Innere Systematik der Echten Elstern nach Lee et al. 2003[12] |
Die Gelbschnabelelster, die Schwesterart der Hudsonelster, bewohnt die warmen, trockenen Regionen Kaliforniens. Ursprünglich wurde angenommen, die Gelbschnabelelster sei während des Pleistozäns an die Pazifikküste verdrängt und durch eingewanderte Elstern verdrängt worden. Der Vorfahr beider Arten wanderte aber wahrscheinlich vor rund 1,5 Millionen Jahren[13] über die Beringstraße nach Nordamerika ein und spaltete sich vor 625.000–750.000 Jahren in die heute bestehenden Arten auf.[14] Die Art ist monotypisch, das heißt für die Hudsonelster werden keine Unterarten anerkannt. Weil sie nur eine geringe genetische Distanz zu anderen Echten Elstern aufweist, fordern einige Autoren, alle Arten der Gattung in der Art Pica pica zusammenzufassen.[9]
Bestand, Siedlungsdichte und Gefährdung
Der Bestand der Hudsonelster gilt als ungefährdet. Vogelzählungen im Rahmen des jährlichen Christmas Bird Count ergaben stabile Zahlen, lediglich in Nebraska und North Dakota gab es stärkere Rückgänge. Die Siedlungsdichte variiert je nach Brutplatz- und Nahrungsangebot stark und wird auch durch menschliche Verfolgung beeinflusst. So liegt sie im südöstlichen Idaho bei 35 Nestern pro km², bei 10–16 Nestern in Utah und 2 Nestern in South Dakota. Regional werden Brutpopulationen vor allem durch den Rückgang und die Fragmentation geeigneter Uferhabitate, Nachstellung mit Giftködern und Schusswaffen sowie die Störung von brütenden Paaren, Insektizide und die Ansiedlung von Fuchshörnchen in ihrem Lebensraum bedroht. Die Hudsonelster wurde wie auch viele andere Arten in den Vereinigten Staaten durch den Migratory Bird Treaty Act von 1918 vor Verfolgung geschützt, dennoch hält diese aber in Kanada wie in den Vereinigten Staaten an.[3]
Kulturgeschichte
Die Hudsonelster ist in allen Kulturen in ihrem Verbreitungsgebiet Teil von Erzählungen und Mythen, wird in diesen aber oft nur anekdotisch erwähnt. Wie auch bei vielen anderen Rabenvögeln spielte ihre Ruffreudigkeit, ihre Lernfähigkeit und ihre Neugier dabei eine wichtige Rolle. Als Aasfresser folgte sie regelmäßig den Bisonjägern in den Great Plains und profitierte von den unverwerteten Teilen der getöteten Rinder.[3] Ihre Federn und andere Teile ihres Körpers wurden von den Bewohnern der Great Plains vor allem in kriegerischen Zusammenhängen als Schmuck verwendet. Als Aasfresser stand sie wahrscheinlich in einem symbolischen Zusammenhang mit dem Krieg.[15] Sie waren auch als Futterräuber berüchtigt, bei Ankunft der Lewis-und-Clark-Expedition an der Pazifikküste fanden die Teilnehmer äußerst furchtlose Hudsonelstern vor, die in die Zelte eindrangen um Nahrung zu entwenden. In der Regel wurden sie als freundlich wahrgenommen. Die Bildung der Winterschwärme galt etwa bei den Tlingit als wichtiges Zeichen der herannahenden kalten Jahreszeit.[16]
Mit der zunehmenden Verfolgung durch die europäischen Siedler und die Farmer späterer Generationen wurden Hudsonelstern scheuer; gleichzeitig wurden sie überwiegend als Schädlinge betrachtet, die andere Vogelarten gefährdeten, Rinderherden schädigen könnten und sich an der Ernte vergingen. Damit einher gingen groß angelegte Verfolgungs- und Ausrottungskampagnen, die weiter zum Negativbild der Art und zum Entstehen ihrer Scheue beitrugen.[3]
Literatur
- Tim Birkhead: The Magpies. The Ecology and Behaviour of Black-Billed and Yellow-Billed Magpies. T & AD Poyser, London 1991. ISBN 978-1-4081-4024-6.
- Steven D. Emslie: Avian Community, Climate, and Sea-Level Changes in the Plio-Pleistocene of the Florida Peninsula. In: Ornithological Monographs 50, 1998. S. 1–113.
- Peter Enggist-Düblin, Tim Robert Birkhead: Differences in the Calls of European and North American Black-billed Magpies and Yellow-billed Magpies. In: Bioacoustics 4, 1992. S. 185–194.
- Derek Goodwin: Crows of the World. 2. Auflage. The British Museum (Natural History), London 1986. ISBN 0-565-00979-6.
- Joseph del Hoyo, Andrew Elliot, David Christie (Hrsg.): Handbook of the Birds of the World. Volume 14: Bush-shrikes To Old World Sparrows. Lynx Edicions, Barcelona 2009. ISBN 978-84-96553-50-7.
- Eugene S. Hunn, Thomas F. Thornton: Tlingit Birds: An Annotated List with a Statistical Comparative Analysis. In: Sonia Tidemann, Andrew Gosler (Hrsg.): Ethno-ornithology. Birds, Indigenous Peoples, Cultures and Society. Earthscan, London und Washington, D. C., 2010. ISBN 978-1-84407-783-0.
- Edwin Richard Kalmbach: The Magpie in Relation to Agriculture. In: USDA Technical Bulletin 24, 1927. S. 1–27. (Volltext)
- Gerhard Kooiker, Claudia Verena Buckow: Die Elster. Ein Rabenvogel im Visier. Aula Verlag, Wiesbaden 1999. ISBN 3-89104-633-2.
- Sang-im Lee, Cynthia S. Parr, Youna Hwang, David P. Mindell, Jae C. Choea: Phylogeny of Magpies (Genus Pica) Inferred from mtDNA Data. In: Molecular Phylogenetics and Evolution 29, 2003. doi:10.1016/s1055-7903(03)00096-4, S. 250–257.
- Steve Madge, Hilary Burn: Crows & Jays. Princeton University Press, Princeton 1994, ISBN 0-691-08883-7.
- Joseph Sabine: Zoological Appendix. In: John Franklin: Narrative of a Journey to the Shores of the Polar Sea, in the Years 1819, 20, 21, and 22. John Murray, London 1823. doi:10.5962/bhl.title.3631, S. 647–703.
Weblinks
- Pica hudsonia in der Roten Liste gefährdeter Arten der IUCN 2017. Eingestellt von: BirdLife International, 2017. Abgerufen am 14. September 2021.
- Videos, Fotos und Tonaufnahmen zu Pica hudsonia in der Internet Bird Collection
- Charles H. Trost: Black-billed Magpie (Pica hudsonia). In: A. Poole: The Birds of North America Online. Cornell Lab of Ornithology, Ithaca 1999. doi:10.2173/bna.389.
Einzelnachweise
- Sabine 1823, S. 671–672.
- Madge & Burn 1994, S. 120.
- Trost 1999. Abgerufen am 5. März 2012.
- Madge & Burn 1994, S. 121.
- Enggist-Düblin & Birkhead 1992, S. 185.
- Emslie 1998, S. 74.
- Kalmbach 1927, S. 8–9.
- Kooiker & Buckow 1999, S. 94.
- del Hoyo et al. 2009, S. 606.
- Birkhead 1991, S. 20.
- Goodwin 1986, S. 154.
- Lee et al. 2003, S. 255.
- del Hoyo et al. 2009, S. 505.
- Lee et al. 2003, S. 256.
- Birkhead 1991, S. 217.
- Hunn & Thornton 2010, S. 199–200.