Homoaromatizität
Die Homoaromatizität aus dem Gebiet der organischen Chemie findet sich in konjugierten cyclischen Systemen, die in der Lage sind, einen Teil des Rings zu überspringen. Sie stehen damit im Gegensatz zur regulären Aromatizität, die nur bei planaren konjugierten Systemen zu finden ist. Genau wie normale aromatische Verbindungen sind auch homoaromatische Verbindungen stabiler als aufgrund der reinen Konjugation zu erwarten wäre.
Konzept der Homoaromatizität
Das Konzept der Homoaromatizität wurde von Saul Winstein entwickelt[1][2] und als erstes bei einem 3-Bicyclo[3.1.0]hexyl-Kation beobachtet (Abb. 1).
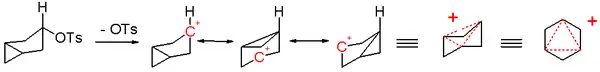
Es wurde festgestellt, dass die Solvolyse-Reaktion viel schneller ablief, wenn sich die Tosyl-Abgangsgruppe in äquatorialer und nicht in axialer Position am Ring befand, wodurch die anchimere Unterstützung der Cyclopropan-σ-Orbital zum nichtklassischen Ion erleichtert wurde. Die positive Ladung in diesem Ion ist über drei Kohlenstoffatome delokalisiert, die zwei π-Elektronen aufweisen und damit die Hückel-Regel erfüllen. Insgesamt drei Methylengruppen sind aus dem konjugierten System ausgeschlossen, daher handelt es sich bei dem Ion um einen Trishomoaromaten.
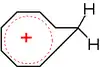
Ein weiteres Beispiel eines homoaromatischen Systems ist das sechs π-Elektronen enthaltende Homotropylium-Ion (Abb. 2).
Bishomoantiaromatizität
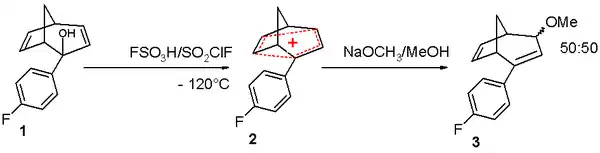
Das verbrückte Bicyclo[3.2.1]octa-3,6-dien-2-ylkation, das in Abbildung 3 dargestellt ist, ist bishomoantiaromatisch, da es vier π-Elektronen enthält, womit es antiaromatische ist[3]. Das Kation wird bei niedrigen Temperaturen in einem supersauren Lösungsmittel dargestellt, das aus Fluorsulfonsäure und Sulfurylchloridfluorid besteht. Das Kation kann mit einem Methanolat-Anion rekombinieren, wobei eine 50/50-Mischung der Isomere entsteht. Das antiaromatische Verhalten des Systems konnte mittels NMR-Analyse und den Reaktionsgeschwindigkeiten bei Solvolyse-Experimenten nachgewiesen werden.
Weblinks
- Eintrag zu Homoaromatic. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.H02839 – Version: 2.3.1.
Einzelnachweise
- S. Winstein, Joseph Sonnenberg, Louis De Vries: The tris-homocyclopropenyl cation In: Journal of the American Chemical Society. Band 81, Nr. 24, 1959, doi:10.1021/ja01533a051, S. 6523–6524.
- S. Winstein: Homo-aromatic structures. In: Journal of the American Chemical Society. Band 81, Nr. 24, 1959, doi:10.1021/ja01533a052, S. 6524–6525.
- Heinrich Volz, Jung-Hyu Shin: Bicyclo[3.2.1]octa-3,6-dien-2-yl Cation: A Bishomoantiaromate. In: Journal of the American Chemical Society. Band 71, Nr. 6, 2006, doi:10.1021/jo0515125, S. 2220–2226.