Rhinophore
Rhinophoren (altgr. ῥίς rhis ‚Nase‘, φορος phoros ‚tragend‘) sind olfaktorische Sinnesorgane, die paarig als keulenförmige, stabförmige, fächerförmige oder schüsselförmige Ausstülpungen am Kopf vieler mariner Weichtiere auftreten. Sie sind charakteristisch für Hinterkiemerschnecken, insbesondere Nacktkiemer.[1] Auch bei Kopffüßern wie dem Perlboot (Nautilus pompilius) sind Rhinophoren beschrieben.[2]


Für Meerestiere stellt der Geruchssinn eine entscheidende sensorische Modalität für den Fernempfang dar, da auditive und visuelle Informationen im Wasser nur begrenzt verfügbar sind.[3]
Verhältnisse bei Hinterkiemerschnecken
Beschreibung am Kalifornischen Seehasen
Der prinzipielle Aufbau von Rhinophoren wird hier am Beispiel des Kalifornischen Seehasen (Aplysia californica) beschrieben.[4]
- Funktion
Bei der Gattung Aplysia dienen die Rhinophoren der Fernwahrnehmung von Substanzen wie Duft- und Geschmacksstoffen sowie der Rheorezeption (Strömungswahrnehmung). Eine große Anzahl von Chemorezeptoren auf der Oberfläche der Rhinophoren ermöglicht ein feines Wahrnehmungsvermögen, mit Hilfe dessen die Schnecke Nahrungsquellen findet. Ferner konnte nachgewiesen werden, dass sie mittels der Rhinophoren Pheromone (Lock und Botenstoffe) erkennen.[4]
- Aufbau
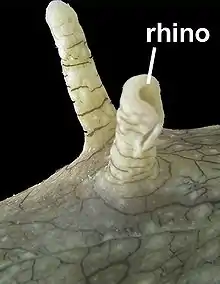
Bei Aplysia sind die Rhinophoren stäbchenförmige Gebilde, die aus der Kopfoberseite heraustreten. Im Vergleich zur Größe des Tieres sind sie meist recht klein: bei einem ausgewachsenen Kalifornischen Seehasen betrug ihre Länge nur etwa 1 cm.[4]
Das physische Wahrnehmungszentrum der Rhinophoren ist in einer Furche an deren Spitze enthalten. Die Wahrnehmung erfolgt über spezialisierte Haarzellen (Ziliarzellen) oder Protuberanzen (kleine Ausstülpungen) an der Oberfläche des Außengewebes. Diese Haarzellen sind Chemorezeptoren für Duft- und Geschmackstoffe.
Der Eingang in das Nervensystem erfolgt über Neuronen, die im Gewebe (Epithel) im Furchenraum eingelagert sind. Die Dendriten dieser Neuronen sind mit den Haarzellen und Protuberanzen verbunden. Bei Wahrnehmung von Substanzen durch die Rezeptorzellen an der Oberfläche werden die Neuronen aktiviert. Die Neuronen leiten das Eingangssignal dann über ihre Axone zum Rhinophorenganglion (Ansammlung von Nervenzellen und Verarbeitungszentrum im Nervensystem der Schnecke) weiter (Projektion).[4]
 Rhinophorenspitze eines Kalifornischen Seehasen (Aplysia californica)
Rhinophorenspitze eines Kalifornischen Seehasen (Aplysia californica)
Elektronenmikroskop: niedrige Auflösung
Skala: Balken=300 μm.
rg – Rhinophorenfurche
tip – Rhinophorenspitze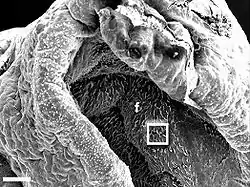 Rhinophorenfurchen mit Ziliarzellen an der Epitheloberfläche eines Kalifornischen Seehasen
Rhinophorenfurchen mit Ziliarzellen an der Epitheloberfläche eines Kalifornischen Seehasen
Elektronenmikroskop: mittlere Auflösung
Skala: Balken=100 μm.
f – Faltungen
Quadrat – nächster Ausschnitt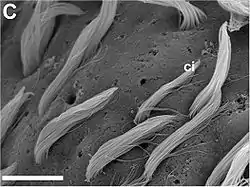 Poren mit und ohne austretende Zilienbündel.
Poren mit und ohne austretende Zilienbündel.
Elektronenmikroskop: hohe Auflösung.
Skala: Balken=10 μm.
ci – Zilien verschiedener Länge
In der Schlundnähe besitzen die Kalifornischen Seehasen Tentakel, die ebenfalls mit Rezeptorzellen besetzt sind und der Sinneswahrnehmung dienen. Eine Funktionsüberlappung wird nicht angenommen, sondern die Arbeitsgruppe vermutet, dass die Tentakelrezeptoren eher Chemo- oder Mechanorezeptoren zur Kontaktwahrnehmung sind.[4]
Beweglichkeit von Rhinophoren
Die Abbildung vom Kopf der Koi-Prachtsternschnecke deutet an, dass Rhinophoren nicht nur starre Aufsätze sind. In der Tat können einige Schnecken ihre Rhinophoren in verschiedene Richtungen ausrichten.
Die Antennenform der Rhinophoren ist zwar gut für die zu erfüllenden Aufgaben, macht sie jedoch gleichzeitig zu sensiblen Angriffspunkten für ihre natürlichen Feinde: die Rhinophoren sind leicht abzureißen, an- bzw. abzufressen. Um das zu vermeiden, sind viele Nacktkiemer in der Lage, ihre Rhinophoren in Taschen unterhalb der Hautoberfläche einzuziehen.
Formen von Rhinophoren
Die Formen von Rhinophoren verschiedener Arten differieren in der Form der sensorischen Felder, in der Position und in der Form des Organs. Viele Rhinophoren haben als Grundform zwei Stabstrukturen mit aufgesetzten sensorischen Feldern. Längliche Formen sind einfache, flexible Konstruktionen. Sie können in diverse Richtungen geneigt, gedreht und zum Schutz verborgen werden. Andererseits sind Stabstrukturen nicht sehr raumgreifend. Die Abbildungen von Canthodoris pilosa, Chromodoris annulata und der Koi-Prachtsternschnecke zeigen Aufsätze mit sensorischen Feldern unterschiedlicher Form, Länge und Riefung. Bei der Koi-Prachtsternschnecke ist fast der gesamte Stab mit spiraligen Riefen belegt, bei der Canthodoris pilosa nur der obere Teil. Des Weiteren sind u. a. noch Felder in Bürstenform, Federform, mit Längsfalten, sowie sich am Stabende auffächernde Felder dokumentiert.[5] Bürsten, Federn und Fächer sind geometrische Formen mit großen Oberflächen auf geringem Raum.
Neben Schnecken mit rein stabförmigen Rhinophoren gibt es Schnecken (Sternenschnecke Bornella stellifer), bei denen die Organe keine Kopfausstülpungen sind, sondern sich verzweigenden Tentakeln entstammen.
Verhältnisse bei Kopffüßern
Was bisher (Stand 2017) über die Sensorik bei Kopffüßern bekannt ist, stammt meist aus Studien am Perlboot. Im olfaktorischen System der Perlboote befindet sich unterhalb jeden Auges ein Paar Rhinophoren. Diese stehen mit einer winzigen Pore im ständigen Stoffaustausch mit ihrer Umgebung. Bei Tintenfischen (sowohl Achtarmigen wie Zehnarmigen) befindet sich zu jeder Seite des Kopfes unterhalb der Augen, in der Nähe des Mantelrandes, eine kleine Grube von Flimmerzellen.[6] Beim Ergreifung von Beute müssen Kopffüßer nicht nur schneller durch das Wasser schwimmen, auch die Atmung ist erhöht und steigert die Intensitivität des Wasserkontakts im Bereich des Mantelrandes, sodass auch in lichtarmen Bereichen durch die Geruchsleitung Jagden (und Balzen) erfolgreich verlaufen (obgleich etliche Tintenfische wie Sepien auch unabhängig vom Tageslicht aktiv sind). Die Geruchsaufnahme wird nochmals gesteigert, indem sich die Tentakel zum Ergreifen der verfolgten Beute trichterförmig nach vorne öffnen (cone of search).[7]
Olfaktorische Wahrnehmung
Gegenüber dem Seh- und Hörsinn weist die olfaktorische Wahrnehmung einige Besonderheiten auf.
Seh- und Hörsinn basieren auf Wellen (Licht-, Schallwellen). Wellen breiten sich relativ schnell und gleichmäßig aus. Die Signalübertragung folgt dem Dominosteinprinzip. Wird eine Kette von Dominosteinen angestoßen, bleiben alle Dominosteine an Ort und Stelle, ändern aber ihren Zustand von „stehend“ in „gefallen“, und der letzte fallende Stein teilt dem Empfänger mit, dass der Sender die Kette zuvor angestoßen hat. Physisch übertragen werden also physikalische Zustände, nicht aber Bauteile. Ferner genügen verhältnismäßig wenige Typen von Rezeptorzellen für die Wahrnehmung. Im menschlichen Auge sind z. B. Stäbchenzellen für das nächtliche Hell-Dunkel-Sehen und drei Typen von Zapfenzellen für das Herausfiltern von Frequenzbändern (Anteil an Rot-, Grün-, Blaulicht) beim Tagssehen verantwortlich.
Bei der olfaktorischen Wahrnehmung müssen fluktuierende Moleküle chemischer Substanzen aus dem Trägermedium (Wasser) herausgefiltert und zugeordnet werden. Das Herausfiltern geschieht oft durch das Andocken und Eingehen chemischer Bindungen, die dann eine interne Signalkette auslösen. Für das "Erkennen" vieler Substanzen wird daher auch ein hinreichend breites Spektrum an Rezeptorzellen benötigt (ein Mensch hat ~320 unterschiedliche Chemorezeptoren, ein Schäferhund ~1200). Die Signalübertragung erfolgt über den physischen Transfer von Molekülen vom Ausgangs- zum Wahrnehmungsort. Sie unterliegen auf der Signalstrecke Einflüssen des Transportmediums (z. B. Strömungen). Chemische Signale sind daher, wenn sie nicht sehr stark sind, diffus und nicht so gerichtet wie Licht- und Schallwellen.
Daraus kann man allgemeine Gütekriterien für olfaktorische Sinnesorgane aufstellen:
- pro Chemorezeptor-Typ sollten möglichst viele Rezeptor-Moleküle vorhanden sein,
- die Rezeptoren sollten möglichst nicht punktuell konzentriert, sondern sinnvoll räumlich verteilt werden,
- je mehr Typen an Chemorezeptoren, desto differenzierter die Wahrnehmung.
Verteilte Rezeptorflächen mit Durchsetzung verschiedener Rezeptortypen sind daher besonders wirkungsvoll.
Etymologie
Der Name Rhinophore leitet sich von seiner Funktion als Riechorgan ab. „Rhino-“ kommt vom alt-griechischen Wort ῥίς rhis für ‚Nase‘. „Phore“ stammt ab vom (neulateinischen) „phore“ für ‚tragen‘ und vom griechischen Wort φορος phoros ‚tragend‘.
Literatur
- Luise Schmekel, Adolf Portmann: Opisthobranchia des Mittelmeeres: Nudibranchia und Saccoglossa. Springer-Verlag, Berlin Heidelberg New York 1982. Anatomie der Nudibranchia, Rhinophoren: S. 19 f.
- Adrian Wertz, Wolfgang Rössler, Malu Obermayer, Ulf Bickmeyer: Functional neuroanatomy of the rhinophore of Aplysia punctata. In: Frontiers in Zoology. Band 3, Nr. 1, 6. April 2006, ISSN 1742-9994, S. 6, doi:10.1186/1742-9994-3-6 (frontiersinzoology.com).
Einzelnachweise
- Volker Storch, Ulrich Welsch: Über Bau und Funktion der Nudibranchier-Rhinophoren. In: Zeitschrift für Zellforschung und mikroskopische Anatomie, Band 97, Nr. 4, 1969, S. 528–536.
- Peter Ruth, Henrike Schmidtberg, Bettina Westermann, Rudolf Schipp: The sensory epithelium of the tentacles and the rhinophore of Nautilus pompilius L. (cephalopoda, nautiloidea). In: Journal of Morphology, Band 251, Nr. 3, März 2002, S. 239–255, doi:10.1002/jmor.1086 (PDF).
- Adrian Wertz, Wolfgang Rössler, Malu Obermayer, Ulf Bickmeyer: Functional neuroanatomy of the rhinophore of Aplysia punctata. In: Frontiers in Zoology, Band 3, Nr. 1, April 2006, Artikel 6, S. 1–11 (PDF).
- Scott F. Cummins, Dirk Erpenbeck, Zhihua Zou, Charles Claudianos, Leonid L. Moroz, Gregg T. Nagle, Bernard M. Degnan: Candidate chemoreceptor subfamilies differentially expressed in the chemosensory organs of the mollusc Aplysia. In: BMC Biology. Band 7, Nr. 1, 4. Juni 2009, ISSN 1741-7007, S. 28, doi:10.1186/1741-7007-7-28 (biomedcentral.com).
- Sea Slug: Formen von Rhinophoren
- Anna Di Cosmo, Gianluca Polese: Cephalopod olfaction. In: Oxford Research Encyclopedia of Neuroscience, Juli 2017, doi:10.1093/acrefore/9780190264086.013.185.
- Vanessa Fontoura-da-Silva, Renato Junqueira de Souza Dantas, Carlos Henrique Soares Caetano: Foraging tactics in Mollusca: A look into the feeding behavior of their most obscure classes (Aplacophora, Monoplacophora, Polyplacophora, Scaphopoda and Cephalopoda). In: Oecologia Australis, Band 17, Nr. 3, September 2017, S. 358–373, doi:10.4257/oeco.2013.1703.04 (PDF).