Hexahydroxybenzol
Hexahydroxybenzol ist eine organische Substanz mit der Summenformel C6H6O6. Es liegt bei Raumtemperatur in kristalliner Form vor und löst sich in heißem Wasser.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
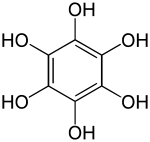 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Hexahydroxybenzol | ||||||||||||||||||
| Summenformel | C6H6O6 | ||||||||||||||||||
| Kurzbeschreibung |
weißer bis gelblicher Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 174,11 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Schmelzpunkt |
310 °C[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Geschichte
Es wurde zuerst in Form seines Hexakaliumsalzes durch Justus von Liebig bei Versuchen zur Umsetzung von Kohlenstoffmonoxid mit Kalium im Jahr 1834 gefunden. Durch Überleiten von Kohlenstoffmonoxid über geschmolzenes Kalium gelangte er zu einer Substanz mit der Summenformel KCO, die er Kohlenoxidkalium nannte, jedoch nicht als Salz des Hexahydroxybenzols erkannte.[3][4] Die Struktur klärten B. Nietzki und T. Benckiser 1885 auf, sie erhielten durch Hydrolyse des Materials Hexahydroxybenzol.[5]
Herstellung
Hexahydroxybenzol kann durch Dehydrierung von Inosit erhalten werden. Ein weiterer Weg ist die Reduktion des Natriumsalzes von 2,3,5,6-Tetrahydroxy-1,4-benzochinon mit Zinn(II)-chlorid und Salzsäure.
Reaktionen
Die Oxidation von Hexahydroxybenzol führt zu 2,3,5,6-Tetrahydroxy-1,4-benzochinon (THBQ), Rhodizonsäure und Dodecahydroxycyclohexan.[6] Mit 2,2′-Bipyridin bildet es Addukte im molaren Verhältnis von 1:2.[7] Durch Alkalimetalle wird es in sein sechsfach negativ geladenes Anion C6O66− überführt. Mit Säuren wie Essigsäure bildet es Hexaester.
Einzelnachweise
- Eintrag zu Hexahydroxybenzol bei TCI Europe, abgerufen am 3. März 2014.
- Alexander J. Fatiadi, W. F. Sager: Hexahydroxybenzene (Benzenehexol) In: Organic Syntheses. 42, 1962, S. 66, doi:10.15227/orgsyn.042.0066; Coll. Vol. 5, 1973, S. 595 (PDF).
- W. E. Trout: The metal carbonyls. In: J. Chem. Educ. 1937, 14 (10), S. 453 (doi:10.1021/ed014p453).
- W. A. Herrmann: 100 Jahre Metallcarbonyle. Eine Zufallsentdeckung macht Geschichte. In: Chemie in unserer Zeit. 1988, 22. Jahrg., Nr. 4, S. 113–122 (doi:10.1002/ciuz.19880220402).
- W. Büchner, E. Weiss: Zur Kenntnis der sogenannten „Alkalicarbonyle“. Über die Reaktion von geschmolzenem Kalium mit Kohlenmonoxid. In: Helvetica Chimica Acta. 47, 1964, S. 1415–1423 (doi:10.1002/hlca.19640470604).
- Alexander J. Fatiadi, Horace S. Isbell, William F. Sager: Cyclic Polyhydroxy Ketones. I. Oxidation Products of Hexahydroxybenzene (Benzenehexol). In: Journal of Research of the National Bureau of Standards Section a-Physics and Chemistry, vA 67 (1963): S. 153–158 (PDF).
- John A. Cowan, Judith A. K. Howard, Michael A. Leech, Horst Puschmann, Ian D. Williams: Hexahydroxybenzene-2,2'-bipyridine (1/2). In: Acta Crystallographica Section C: Crystal Structure Communications. 57, 2001, S. 1194–1195 (doi:10.1107/S0108270101011350).
