Frenkel-Defekt
Frenkel-Defekte (auch: Frenkel-Fehlordnung oder Frenkel-Paare) sind bestimmte, in Kristallgittern vorkommende Gitterfehler. Sie zählen neben den Schottky-Defekten zu den wichtigsten Punktfehlern. Sie sind nach dem russischen Physiker Jakow Iljitsch Frenkel benannt, der sie 1926 erstmals beschrieb.[1]
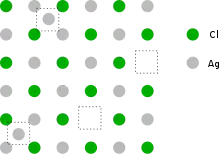
Beschreibung
Ein Frenkel-Defekt entsteht dadurch, dass ein Ion oder Atom seinen regulären Gitterplatz verlässt und auf eine normalerweise nicht besetzte Position im Kristallgitter wandert. Dadurch entstehen jeweils eine Leerstelle und ein Zwischengitteratom (bzw. ein Zwischengitterion). Dies ist durch die geringere Ordnung entropisch günstiger, allerdings erhöht sich die Energie des Kristalls. So erhöht sich die Energie von Kupfer mit jeder Leerstelle um 1,2 eV, mit jedem Atom auf einem Zwischengitterplatz um 3,4 eV.[2] Da es energetisch günstiger ist, wenn das kleinere Atom auf einem Zwischengitterplatz liegt, finden sich Frenkel-Defekte in der Regel bei den Kationen eines Gitters, die kleiner sind als Anionen.
Frenkel-Defekte sind eine natürliche Eigenschaft vieler Ionenkristalle, d. h. sie liegen schon im chemischen Gleichgewicht vor. Die Konzentration der Leerstellen kann formal über eine Art Massenwirkungsgesetz beschrieben werden. Die Anzahl der Frenkel-Defekte nimmt mit steigender Temperatur zu.[3]
Vorkommen
Frenkel-Defekte finden sich vor allem in Strukturen, die größere unbesetzte Leerstellen wie Oktaederlücken besitzen; hierzu zählen etwa die Sphalerit-, Spinell- und Fluoritstruktur. In Verbindungen mit Natriumchloridstruktur findet man dagegen nur selten Frenkel-Defekte, ein Beispiel hierfür ist Silberchlorid[4], während etwa Alkalimetallhalogenide oder Erdalkalimetalloxide keine Frenkel-Defekte besitzen.[5]
Fluorit-Struktur
Der seltenere Fall, dass die meist größeren Anionen auf Zwischengitterplätzen liegen, wird häufig auch Anti-Frenkel-Defekt genannt. Er findet sich in vielen Verbindungen der Fluoritstruktur, bei der die Anionen in den kleineren Tetraederlücken liegen und durch den Defekt in die größeren Oktaederlücken gelangen.[4]
Entstehung
Frenkel-Defekte können durch verschiedene Prozesse entstehen. Zu diesen zählen[6]
- Kristallisation
- Abschrecken
- Umformen
- Wärmebehandlung
- radioaktive Bestrahlun
- Schnitte durch Versetzungslinien.
Außerdem entstehen Defekte oberhalb des absoluten Nullpunkts ständig von selbst und verschwinden wieder, wenn durch Diffusion im Festkörper eine Leerstelle und ein Ion auf einem Zwischengitterplatz wieder aufeinandertreffen. Im thermodynamischen Gleichgewicht halten sich die beiden Prozesse die Waage.
Einzelnachweise
- J. Frenkel: Über die Wärmebewegung in festen und flüssigen Körpern. In: Zeitschrift für Physik. 1926, 35, S. 652–669, doi:10.1007/BF01379812.
- Ulrich Leute: Physik und ihre Anwendungen in Technik und Umwelt. 2. Auflage, Hanser Verlag, 2004, ISBN 978-3-4462-2884-9, S. 379.
- Kristallbaufehler. In: Römpp Chemie Lexikon. Thieme Verlag, Stand März 2002.
- Ralf Alsfasser, Erwin Riedel, C Janiak, H. J. Meyer: Moderne anorganische Chemie. 3. Auflage, Walter de Gruyter, 2007, ISBN 978-3-1101-9060-1, S. 380.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1764.
- Peter Kurzweil, Paul Scheipers: Chemie: Grundlagen, Aufbauwissen, Anwendungen und Experimente. 8. Auflage, Vieweg+Teubner Verlag, 2009, ISBN 978-3-8348-0341-2, S. 98.