Flory-Huggins-Modell
Das Flory-Huggins-Modell beschreibt das Verhalten von Polymerlösungen und wurde von Paul Flory und Maurice Loyal Huggins entwickelt. Es handelt sich um ein Gittermodell.

Polymere lösen sich in einem Lösungsmittel, wenn sich dadurch die Gibbs-Energie des Systems verringert, d. h., die Änderung der Gibbs-Energie (ΔG) negativ ist. Aus der bekannten Legendre-Transformation der Gibbs-Helmholtz-Gleichung geht hervor, dass ΔG aus der Mischungsenthalpie (ΔH) und Mischungsentropie (ΔS) zusammengesetzt ist.
Würden keine Wechselwirkungen zwischen den beteiligten Stoffen bestehen, so wäre keine Mischungsenthalpie vorhanden und die Mischungsentropie wäre ideal. Die ideale Mischungsentropie von mehreren Reinstoffen ist immer positiv (der Term -T·ΔS dann negativ) und ΔG wäre bei jedem Mischungsverhältnis negativ. Es wäre vollständige Mischbarkeit gegeben. Daraus folgt, dass Mischungslücken mit Wechselwirkungen zwischen den Komponenten erklärt werden müssen. Im Falle einer Polymerlösung müssen Polymer-Polymer, Lösungsmittel-Lösungsmittel und Polymer-Lösungsmittel-Wechselwirkungen berücksichtigt werden und ebenso die veränderte Entropie einer Polymerlösung, welche durch einen Random Walk hergeleitet wird.[1] Der resultierende Ausdruck für die Änderung der Gibbs-Energie basiert auf einem für Polymere angepassten Term für die ideale Mischungsentropie und einem Wechselwirkungsparameter, welcher die Summe aller Wechselwirkungen beschreibt.[1][2]
mit
- = universelle Gaskonstante
- = Anzahl von besetzten Gitterplätzen pro Molekül (für Polymerlösungen ist m1 näherungsweise der Polymerisationsgrad und m2=1)
- = Volumenanteil des Polymers und des Lösungsmittels
- = Wechselwirkungsparameter
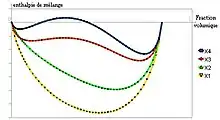
Aus der Flory-Huggins-Theorie folgt zum Beispiel, dass die obere kritische Lösungstemperatur (upper critical solution temperature, UCST) sich, falls vorhanden, mit zunehmender molarer Masse erhöht und sich gleichzeitig in die lösungsmittelreiche Zone verschiebt. Ob ein Polymer UCST- und/oder LCST-Verhalten (LCST = lower critical solution temperature oder untere kritische Lösungstemperatur) aufweist, lässt sich aus der Temperaturabhängigkeit des Wechselwirkungsparameters ableiten (siehe Abbildung). Es ist zu beachten, dass der Wechselwirkungsparameter nicht nur enthalpische Elemente enthält, sondern auch die nicht-ideale Mischungsentropie (z. B. den sehr starken hydrophoben Effekt in wässriger Lösung). Da der Wechselwirkungsparameter sowohl enthalpische als auch entropische Elemente enthält, die wiederum aus vielen Einzelkomponenten zusammengesetzt sind, lässt die klassische Flory-Huggins-Theorie nur schwer Rückschlüsse auf die molekulare Ursache von Mischungslücken zu.
Eine Erweiterung der des Flory-Huggins-Modells für Polymergele ist das Flory-Rehner-Modell.
Siehe auch
Einzelnachweise
- Menno A. van Dijk, Andre Wakker: Concepts in Polymer Thermodynamics. CRC Press, 1998, ISBN 978-1-56676-623-4, S. 61–65 (Google Books [abgerufen am 26. November 2019]).
- Ronald Koningsveld, Walter H. Stockmayer, Erik Nies: Polymer Phase Diagrams. Oxford University Press, Oxford 2001, ISBN 978-0-19-855635-0.