Kritische Lösungstemperatur
Die untere und obere kritische Lösungstemperatur (engl. lower and upper critical solution temperature, abgekürzt LCST und UCST) beschreibt den Temperaturbereich in dem mehrere Stoffe vollständig mischbar sind. Unterhalb der LCST und oberhalb der UCST sind zwei oder mehrere Stoffe in allen Konzentrationsverhältnissen vollständig mischbar und bilden somit eine einzige Phase.[1] Folglich existiert oberhalb der LCST und unterhalb der UCST eine Mischungslücke für bestimmte Zusammensetzungen. Diese Mischungslücken können durch Temperatur-Zusammensetzungs-Diagramme dargestellt werden (Abbildung 1). Partielle Mischbarkeit mit LCST oder UCST wird besonders häufig beobachtet, wenn Polymere Bestandteil der Mischungen sind.
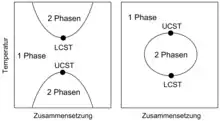
Darstellung im Phasendiagramm
Abbildung 2 zeigt ein idealisiertes Phasendiagramm einer Mischung der Komponenten A und B mit UCST-Mischungslücke. Phasenseparationsprozesse können anhand des Phasendiagramms veranschaulicht werden. Im gezeigten Beispiel bilden die Komponenten A und B beim Mischungsverhältnis c1a und der Temperatur T1 eine homogene Phase. Der Einphasenbereich wird vom Zweiphasenbereich durch die Binodale getrennt. Wird die Temperatur auf T2 erniedrigt, setzt Phasenseparation ein und eine zweite Phase der Zusammensetzung c1b ist im Begriff des Entstehens. Bei einer weiteren Abkühlung zu T3 schreitet die Phasenseparation fort. Eine Phase der Zusammensetzung c2a coexistiert mit einer zweiten Phase der Zusammensetzung c2b. Die zwei Phasen stehen im thermodynamischen Gleichgewicht miteinander. Die Zusammensetzung der coexistierenden Phasen kann graphisch mittels einer horizontalen Hilfslinie, der Konode, ermittelt werden.
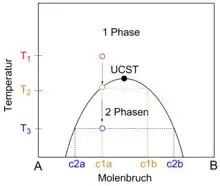
Experimentelle Bestimmung
Ob eine Mischungslücke mit LCST oder UCST vorliegt, lässt sich durch mehrere Methoden feststellen. Weit verbreitet ist die Turbidimetrie.[2] Zwei unterschiedliche Phasen weisen in der Regel unterschiedliche Brechungsindizes auf. Dies führt zu Lichtstreuung, sobald Phasenseparation eintritt, und äußert sich in einer Trübung des Gemisches. Mit Hilfe eines Turbidimeters kann die Trübung in Abhängigkeit von der Temperatur gemessen werden. So wird die Richtung der Phasenseparation (LCST- oder UCST-Verhalten) und der Trübungspunkt (engl. cloud point) festgestellt. Der Trübungspunkt ist abhängig von der Heiz- bzw. Kühlrate und der Zusammensetzung des Stoffgemisches und darf nicht mit LCST oder UCST verwechselt werden. In strikt binären Stoffgemischen befindet sich die UCST am Maximum und die LCST am Minimum der Binodalen, d. h., sie lassen sich nur bei einer kritischen Zusammensetzung des Gemisches beobachten. Da hierfür die Phasenseparation über einen weiten Zusammensetzungsbereich untersucht werden muss, ist die Bestimmung experimentell aufwändig. Deshalb wird die Phasenseparation meist nur in Zusammensetzungsbereichen untersucht, die für den Experimentator interessant sind.
Die Phasenseparation wird begleitet von einer Änderung der Enthalpie, die bei LCST-Übergängen positiv und bei UCST-Übergängen negativ ist. Diese Enthalpieänderungen können durch dynamische Differenzkalorimetrie festgestellt werden.
Beispiele
Gemische niedermolekularer Flüssigkeiten
Mischungen von n-Hexan/Anilin zeigen eine UCST von 60 °C.[3] Der kritische Molenbruch liegt, wie nach der Flory-Huggins-Theorie zu erwarten, bei ca. 0,5 und das Phasendiagramm ist hoch symmetrisch. Phenol/Wasser-Gemische weisen eine UCST von 66 °C auf.[4] Beispiele für LCST-Verhalten sind die Gemische Wasser/Triethylamin oder Wasser/N-isopropylpropionamid mit LCSTs von 18 °C[5] bzw. 28 °C.[6] N-Isopropylpropionamid stellt die Repetiereinheit des Polymers Poly(N-isopropylacrylamid) dar, das ebenfalls eine ähnliche LCST aufweist. Sowohl LCST als auch UCST zeigt das Gemisch Nikotin/Wasser.[7]
Polymerlösungen
Aufgrund der geringen Mischungsentropie treten Mischungslücken bei Polymerlösungen relativ häufig auf.[8] Im Falle von Polymerlösungen sind die Mischungslücken oft sehr breit und der Verlauf der Binodalen ist flach, so dass schon bei kleinen Temperaturänderungen eine drastische Phasenseparation einsetzen kann. Deshalb zählt man Polymere mit LCST oder UCST in einem Lösungsmittel zur Klasse der thermoresponsiven Polymere. In organischen Lösungsmitteln sind sowohl UCST als auch LCST sehr häufig zu beobachten.[9] Beispiele in wässriger Lösung sind ebenfalls bekannt.[10][11]
Polymerblends
Die kombinatorische Mischungsentropie für Polymerblends ist noch geringer als die von Polymerlösungen. Deshalb sind die meisten Polymerblends unmischbar. Partielle Mischbarkeit mit LCST wird beispielsweise bei Polymethylmethacrylat/Polycarbonat-Mischungen beobachtet.[12] UCST-Verhalten ist für Polystyrol/Poly(4-methylstyrol)-Mischungen bekannt.[13]
Feste Lösungen
Feste Lösungen wie Legierungen oder Metall/Metallhydrid-Gemische können Mischungslücken aufweisen. Das System Palladium/Palladiumhydrid besitzt beispielsweise eine UCST bei 300 °C.[7]
Weiterführende Literatur
- R. Koningsveld, W. H. Stockmayer, E. Nies, Polymer Phase Diagrams, Oxford University Press, Oxford 2001.
Einzelnachweise
- Eintrag zu upper critical solution temperature. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.UT07280.
- Y. C. Bae, S. M. Lambert, D. S. Soane, J. M. Prausnitz, Cloud-Point Curves of Polymer Solutions from Thermooptical Measurements, Macromolecules, 1991, Volume 24, S. 4403–4407.
- Donald B. Keyes, Joel H. Hildebrand, A Study of the System Aniline-Hexane., Journal of the American Chemical Society, 1917, Volume 39, S. 2126–2137.
- P. J. Sinko, Martin's Physical Pharmacy and Pharmaceutical Sciences, 5th ed., Lippincott Williams & Wilkins, 2005, Seite 51.
- K. Stephan u. a., Thermodynamik: Grundlagen und technische Anwendungen, Band II, Springer Verlag, ISBN 3-540-64481-4, S. 94. eingeschränkte Vorschau in der Google-Buchsuche.
- B. Geukens, F. Meersman, Erik Nies, Phase Behavior of N-(Isopropyl)propionamide in Aqueous Solution and Changes in Hydration Observed by FTIR Spectroscopy, Journal of Physical Chemistry B, 2008, Volume 112, S. 4474–4477.
- Peter W. Atkins, Physikalische Chemie, Dritte, korrigierte Auflage, Wiley-VCH, Weinheim, 2001.
- Ronald Koningsveld, Walter H. Stockmayer, Erik Nies, Polymer Phase Diagrams, Oxford University Press, Oxford, 2001.
- Christian Wohlfarth, Upper Critical (UCST) and Lower Critical (LCST) Solution Temperatures of Binary Polymer Solutions, Polymer Handbook, 87th ed., CRC press, 2006, chapter 13, S. 19–34, ISBN 978-0849304873.
- Vladimir Aseyev, Heikki Tenhu, Francoise M. Winnik, Non-ionic Thermoresponsive Polymers in Water, Advances Polymer Science, 2010, Volume 242, S. 29–89.
- Jan Seuring, Seema Agarwal, Polymers with Upper Critical Solution Temperature in Aqueous Solution, Macromolecular Rapid Communications, 2012, Volume 33, S. 1898–1920.
- T. Kyu, J. M. Saldanha, Phase separation by spinodal decomposition in polycarbonate/poly(methyl methacrylate) blends, Macromolecules, 1988, Volume 21, S. 1021–1026.
- L. L. Chang, E. M. Woo, Morphology, Phase Diagrams, and UCST Behavior in Blends of Polystyrene with Poly(4-methylstyrene), Macromolecular Chemistry and Physics, 2001, Volume 202, S. 636–644.