Flagelline
Flagelline sind eine Gruppe von Proteinen in Flagellen (synonym Geißeln) von Bakterien und Archaeen. In Verbindung mit den Motorproteinen an der Basis der Flagellen dienen sie der Fortbewegung in Flüssigkeiten.
Eigenschaften
Flagelline sind der Hauptbestandteil der Flagellen, die sich aus 20.000 bis 30.000 helikal angeordneten Flagellineinheiten zusammensetzen.[1] Sie sind glykosylierte globuläre Proteine mit einer Masse zwischen 30 und 60 Kilodalton und lagern sich spontan zu hohlen Zylindern zusammen mit einem inneren Durchmesser von etwa 2 nm. Der äußere Durchmesser liegt bei 20 nm.[2] Der Transport der Flagelline aus dem Cytosol erfolgt innerhalb der Zylinder teilweise mit Hilfe von Chaperonen. Das Flagellenwachstum erfolgt bei Bakterien am distalen Ende der Flagellen, bei Archaeen am proximalen Ende. Bei der periodischen Änderung der Drehrichtung (vom Uhrzeigersinn in den Gegenuhrzeigersinn und umgekehrt) dröseln sich bakterielle Flagellen kurzzeitig in einzelne Filamente auf, archaeische Flagellen nicht. An der Basis der Flagellen bindet der Flagellenhaken an Flagellin, an die Spitze der Flagellen bindet ein Deckelprotein.
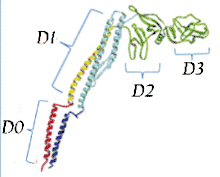
Flagelline von Bakterien besitzen eine unterschiedliche Masse, aber einen konservierten N- und C-Terminus, durch die eine Zusammenlagerung zum Flagellum gewährleistet wird.[2] Beide Termini liegen auf der Innenseite des Flagellums und steuern die Zusammenlagerung des Flagellins zu zwei verschiedenen Protofilamenten, lang und kurz.[2] Der mittlere Teil des Flagellins liegt auf der Außenseite der Flagellen und ist vergleichsweise variabel zwischen den Arten. Die Proteindomänen des Flagellins sind von innen nach außen nummeriert (D0 bis D3), wobei beide Termini in der Domäne D0 liegen. Das Verhältnis aus langen und kurzen Protofilamenten bestimmt die Windung des Flagellums.[2] Während in den meisten begeißelten Bakterienarten nur ein Flagellin vorkommt (bei Escherichia coli codiert durch das Gen fliC), besitzen Sinorhizobium meliloti, Treponema pallidum und Caulobacter crescentus (bei C. crescentus codiert durch die Gene fliM, fliN und fliO) mehrere miteinander verwandte Flagelline.[2]
Immunologie
In Säugetieren bindet der Toll-like-Rezeptor 5 (TLR5) an Flagelline, wodurch in Epithelzellen und dendritischen Zellen die angeborene Immunantwort aktiviert wird.[3][4] In dendritischen Zellen wird zusätzlich die Bildung von T-Helferzellen der adaptiven Immunantwort angeregt.[4] Daher werden Flagelline als Adjuvans untersucht.[5][6][7] Analog lösen Flagelline eine angeborene Immunantwort in Pflanzen aus,[8][9] insbesondere das Flagellin-Peptid flg22.[10] In der Ackerschmalwand (Arabidopsis thaliana) bindet Flagellin an die Rezeptor-Proteinkinase Fls2 (von engl. flagellin-sensitive-2), woraufhin Bak1 (von engl. BRI1-associated kinase 1) gebunden wird und die angeborene Immunantwort ausgelöst wird.[11]
Einzelnachweise
- Keiichi Namba, Ferenc Vonderviszt: Molecular architecture of bacterial flagellum. In: Quarterly Reviews of Biophysics. 30, S. 1, doi:10.1017/S0033583596003319.
- Stanley Falkow: The Prokaryotes. Springer Science & Business Media, 2006, ISBN 978-0-387-25492-0, S. 106.
- N. Sharma, A. S. Akhade, A. Qadri: Sphingosine-1-phosphate suppresses TLR-induced CXCL8 secretion from human T cells. In: Journal of leukocyte biology. Band 93, Nummer 4, April 2013, S. 521–528, doi:10.1189/jlb.0712328, PMID 23345392.
- A. Vijayan, M. Rumbo, C. Carnoy, J. C. Sirard: Compartmentalized Antimicrobial Defenses in Response to Flagellin. In: Trends in Microbiology. Band 26, Nummer 5, 05 2018, S. 423–435, doi:10.1016/j.tim.2017.10.008, PMID 29173868.
- B. Cui, X. Liu, Y. Fang, P. Zhou, Y. Zhang, Y. Wang: Flagellin as a vaccine adjuvant. In: Expert review of vaccines. Band 17, Nummer 4, 04 2018, S. 335–349, doi:10.1080/14760584.2018.1457443, PMID 29580106.
- I. A. Hajam, P. A. Dar, I. Shahnawaz, J. C. Jaume, J. H. Lee: Bacterial flagellin-a potent immunomodulatory agent. In: Experimental & molecular medicine. Band 49, Nummer 9, 09 2017, S. e373, doi:10.1038/emm.2017.172, PMID 28860663, PMC 5628280 (freier Volltext).
- S. B. Mizel, J. T. Bates: Flagellin as an adjuvant: cellular mechanisms and potential. In: Journal of immunology. Band 185, Nummer 10, November 2010, S. 5677–5682, doi:10.4049/jimmunol.1002156, PMID 21048152, PMC 3756556 (freier Volltext).
- A. V. García, H. Hirt: Salmonella enterica induces and subverts the plant immune system. In: Frontiers in Microbiology. Band 5, 2014, S. 141, doi:10.3389/fmicb.2014.00141, PMID 24772109, PMC 3983520 (freier Volltext).
- D. Chinchilla, T. Boller, S. Robatzek: Flagellin signalling in plant immunity. In: Advances in Experimental Medicine and Biology. Band 598, 2007, S. 358–371, doi:10.1007/978-0-387-71767-8_25, PMID 17892224.
- A. V. García, H. Hirt: Salmonella enterica induces and subverts the plant immune system. In: Frontiers in Microbiology. Band 5, 2014, S. 141, doi:10.3389/fmicb.2014.00141, PMID 24772109, PMC 3983520 (freier Volltext).
- D. Chinchilla, C. Zipfel, S. Robatzek, B. Kemmerling, T. Nürnberger, J. D. Jones, G. Felix, T. Boller: A flagellin-induced complex of the receptor FLS2 and BAK1 initiates plant defence. In: Nature. Band 448, Nummer 7152, Juli 2007, S. 497–500, doi:10.1038/nature05999, PMID 17625569.