Enfortumab-Vedotin
Enfortumab-Vedotin ist ein Antikörper-Wirkstoff-Konjugat und wird als Arzneistoff in der Therapie von bestimmten Patienten mit Urothelkarzinom eingesetzt.
| Enfortumab-Vedotin | ||
|---|---|---|
| Masse/Länge Primärstruktur | 152 kDa | |
| Bezeichner | ||
| Externe IDs |
| |
| Arzneistoffangaben | ||
| ATC-Code | L01XC36 | |
| DrugBank | DB13007 | |
| Wirkstoffklasse | Monoklonale Antikörper, Zytostatika | |
Chemie und Eigenschaften
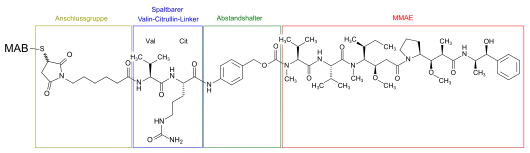
Enfortumab-Vedotin ist ein Antikörper-Wirkstoff-Konjugat, dessen wesentliche Komponenten, ein Antikörper und ein Zytotoxin (Zellgift), kovalent über einen Linker miteinander verbunden sind. Die Bestandteile sind im einzelnen:[1]
- AGS-22C3: ein humaner monoklonaler Antikörper (MAB) vom Typ IgG1-kappa.
- SGD-1006: Linker
- Maleimidocaproyl-Valin-Citrullin-Struktur
- p-Animobenzyl-Carbamat-Struktur
- Monomethylauristatin E (MMAE): Zytotoxin
Die Konjugation erfolgt an Cystinresten des Antikörpers (Disulfidbrücken). Ein Antikörpermolekül bindet im Durchschnitt 3,8 Zytotoxinmoleküle. Die molekulare Masse liegt bei circa 152 kDa.[1] Der Antikörper wird biotechnologisch hergestellt, die Produktion erfolgt mittels CHO-Zellen (Säugerzellen der Ovarien des Hamsters Cricetulus griseus), MMAE wird über chemische Synthese hergestellt.[1] Enfortumab-Vedotin liegt zusammen mit verschiedenen Hilfsstoffen im Arzneimittel als weißliches, wasserlösliches Lyophilisat vor.[1]
Wirkmechanismus
Der Antikörper von Enfortumab-Vedotin richtet sich spezifisch gegen Nectin-4. Dabei handelt es sich um ein Transmembranprotein von Epithelzellen, das an der Zelladhäsion beteiligt ist. Nectin-4 wird in verschiedenen soliden Tumoren exprimiert, so auch in Urothelkarzinomen.[2] Nach intrazellulärer Freisetzung führt Monomethylauristatin E (MMAE) als Hemmstoff der Mikrotubuli zu einem Zellzyklus-Arrest (der Zellzyklus wird unterbrochen), im Folgenden wird durch Apoptose der Zelltod eingeleitet.[1]
Pharmakokinetik
Die Applikation des Arzneistoffs erfolgt als intravenöse Infusion. Der Antikörper dient in erster Linie dem Transport des Zytotoxins. Ist das Zytotoxin an den Antikörper gebunden, wird es nicht in Körperzellen aufgenommen. Der Antikörper-Wirkstoff-Komplex gelangt über den Blutkreislauf zu Zellen, welche Nectin-4 exprimieren, bindet an Nectin-4 und wird anschließend über eine Internalisierung in das Zellinnere aufgenommen. Intrazellulär wird nun die Bindung zwischen dem Antikörper und den Zytotoxinen durch Proteolyse aufgehoben, das Zytotoxin MMAE liegt somit nun frei vor.[1]
Die Infusionsdauer beträgt 30 Minuten. Tmax (Zeitpunkt der maximalen Plasmakonzentration) des Wirkstoffs wird kurz vor Ende der Infusion erreicht, während Tmax von MMAE zwei Tage nach der Verabreichung erreicht wird. Ein Steady State stellt sich nach einem abgeschlossenen Therapiezyklus ein. Nach dem ersten Therapiezyklus liegt die Plasmakonzentration an unkonjugiertem (freiem) MMAE bei circa 4,8 ± 2,7 ng/ ml (Cmax), AUC0-28d von MMAE beträgt 69 ± 42 ng∙dl / ml.[1]
Das mittlere Verteilungsvolumen (Steady State) von Enfortumab-Vedotin wird auf 11 Liter geschätzt. In-vitro-Studien legen eine Plasmaproteinbindung zwischen 68 und 82 Prozent nahe.[1]
Die Plasmahalbwertszeit von Enfortumab-Vedotin liegt bei 3,4 Tage bzw. 2,4 Tage für MMAE. Als mittlere Clearance werden 0,1 L/h (Enfortumab-Vedotin) bzw. 2,7 L/h angegeben. Der Metabolismus von Enfortumab-Vedotin beim Menschen wurde in den Zulassungsstudien nicht erfasst. MMAE wird in-vitro vorwiegend durch CYP3A3 verstoffwechselt. Die Elimination von MMAE wird durch die Freisetzungsrate vom Antikörper limitiert. MMAE in unveränderter Form wird vermutlich vorwiegend über den Stuhl (17 %), zu einem geringeren Anteil über den Harn (6 %) ausgeschieden. Der Antikörper unterliegt enzymatischem Abbau und wird in seine Aminosäuren oder Polypeptide zerlegt.[1]
Anwendung und Zulassung
Enfortumab-Vedotin ist indiziert für die Behandlung von erwachsenen Patienten mit lokal fortgeschrittenem oder metastasiertem Urothelkarzinom. Zuvor muss eine Therapie durch Checkpointinhibitoren (Hemmstoffe des Rezeptors PD-1 oder des Liganden PD-L1) und eine platinbasierte Chemotherapie erfolgt sein (neoadjuvantes oder adjuvantes Therapieschema).[1]
Eine Zulassung für den Arzneistoff liegt in den USA vor. Die Zulassung erfolgte im Dezember 2019 in einem beschleunigten Verfahren auf Basis der bisherigen Studienlage. Die Entscheidung über das Fortbestehen der Zulassung in Abhängigkeit einer Überprüfung des klinischen Nutzens durch die Auswertung weiterer Studien steht noch aus (Stand: Dez. 2020).[1]
Unerwünschte Wirkungen
Hämatologische (das Blut betreffende) Nebenwirkungen können erniedrigte Hämoglobinwerte und verringerte Zahl an Lymphozyten, Neutrophilen und allgemein ein Rückgang der Leukozyten sein. Die Blutwerte für Phosphat, Kalium und Natrium können erniedrigt sein, während es bei Creatinin, Lipasen, Glucose und Harnstoff zu einem Anstieg kommen kann. Häufige Nebenwirkungen sind ferner Fatigue, periphere Neuropathien, Übelkeit, Diarrhoe und trockene Augen. Die vollständige Auflistung der Nebenwirkungen ist den Angaben des Arzneimittelherstellers zu entnehmen.[1]
Bei einem Prozent der Patienten wurde die vorübergehende Bildung von Antikörpern gegen Enfortumab-Vedotin festgestellt, sogenannte ATA-Antikörper (anti therapeutic antibodies). Im Rahmen der Zulassungsstudien wurden 0,3 % der Patienten positiv auf eine persistierende, also dauerhafte, Bildung von ATA-Antikörpern getestet.[1]
Der Einfluss auf die QT-Zeit in empfohlenen Dosierungen wird als gering eingeschätzt, die Verlängerung von QTc beträgt >20 Millisekunden.[1]
Wechselwirkungen mit anderen Arzneistoffen wurden bisweilen nicht systematisch untersucht. Starke CYP3A4-Inhibitoren wie Ketoconazol erhöhen den Plasmaspiegel des Zytotoxins MMAE (Cmax um 25 %, AUC um 34 %). Starke CYP3A4-Inductoren wie Rifampicin reduzieren die Plasmaspiegel von MMAE teils stark (Cmax um 44 %, AUC um 46 %). MMAE ist weiterhin ein Substrat des Transporters P-Glykoprotein, jedoch kein Inhibitor desselben.[1]
Toxikologie
Das Zytotoxin MMAE ist genotoxisch, erwies sich jedoch in verschiedenen Testverfahren (Ames-Test, L5178Y Mauslymphom-Assay) als nicht mutagen. Aus Tierversuchen (Ratte) ergeben sich Hinweise auf eine Beeinträchtigung der männlichen Fruchtbarkeit. Hierbei führten über 13 Wochen hinweg wiederholte Gaben von Enfortumab-Vedotin (Dosis: ≥2 mg/kg) zu einer Abnahme der Masse von Hoden und Nebenhoden. Histologisch zeigten sich eine Degeneration der Hodenkanälchen, verringerte Zellzahl der Spermatide und Spermatozyten sowie Granula, Zelltrümmer, Spermagranulome und Hypospermie. Eine Erholungsphase führte nicht zu einem Rückgang dieser Befunde.[1]
Fertigarzneimittel
Enfortumab-Vedotin wird unter der Handelsbezeichnung Padcev von Astellas Pharma herstellt sowie von Astellas und Seattle Genetics vertrieben. Astellas und Seattle Genetics führten die Entwicklung des Arzneistoffs in Zusammenarbeit durch.[3]
Einzelnachweise
- PADCEVTM – Highlights of Prescribing Information (PDF, engl., Stand der Information: Dez. 2019)
- Gelbe Liste: ASCO 2019: Urothelkarzinom: Nectin-4 als neues Target (aufgerufen am: 20. Dez. 2020)
- Eintrag zu Enfortumab vedotin in der DrugBank der University of Alberta, abgerufen am 18. Dezember 2020.