Eisen(II)-hydroxid
Eisen(II)-hydroxid ist eine anorganische chemische Verbindung des Eisens aus der Gruppe der Hydroxide.
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| _ Fe2+ _ OH− | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Eisen(II)-hydroxid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Verhältnisformel | Fe(OH)2 | |||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 89,86 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte |
3,4 g·cm−3[2] | |||||||||||||||
| Löslichkeit |
| |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Eisen(II)-hydroxid erhält man durch Fällung aus Eisen(II)-Salzlösungen unter Sauerstoffausschluss[5] (z. B. Ammoniumeisen(II)-sulfatlösung mit Natronlauge). Der weiße flockige Niederschlag verfärbt sich aber schnell dunkel unter Bildung von rotbraunem Eisen(III)-hydroxid.[6]
Es bildet sich auch als Zwischenprodukt beim Rosten von Eisen, wobei es infolge des Luftsauerstoffs über wasserhaltiges Eisen(III)-hydroxid FeO(OH) weiter zu rotbraunem Eisen(III)-oxid bzw. bei Sauerstoffmangel zu grünem Magnetit-Hydrat und schwarzem Magnetit umgesetzt wird.[7]
Eigenschaften
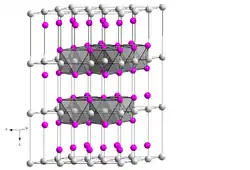
Eisen(II)-hydroxid ist ein nahezu weißer, an Luft unbeständiger Feststoff mit geringem, grünlichem Anflug. Er verbrennt beim Ausstreuen in die Luft unter Funkensprühen. Bei Ausschluss von Sauerstoff sind reine, insbesondere Nickel-, Kupfer- und Cobaltfreie Präparate in Berührung mit Kaliumchlorid-Lösung unterhalb 100 °C völlig stabil. Die Verbindung besitzt eine Kristallstruktur vom Cadmium(II)-hydroxid-Typ mit der Raumgruppe P3m1 (Raumgruppen-Nr. 164) (Gitterparameter a = 325,8 pm, c = 460,5 pm).[1][8] Eisen(II)-hydroxid ist amphoter und löst sich in konzentrierten Laugen unter Bildung von blaugrünen Hydroxoferraten(II), z. B. Na4[Fe(OH)6].[5]
Einzelnachweise
- Georg Brauer (Hrsg.) u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band III, Ferdinand Enke, Stuttgart 1981, ISBN 3-432-87823-0, S. 1646.
- Jean d’Ans, Ellen Lax, Roger Blachnik: Taschenbuch für Chemiker und Physiker. Springer DE, 1998, ISBN 3-642-58842-5, S. 456 (eingeschränkte Vorschau in der Google-Buchsuche).
- K. Rauschert, J. Voigt, I. Wilke, K-Th. Wilke: Chemische Tabellen und Rechentafeln für die analytische Praxis. 11. Auflage. Europa-Lehrmittel, 2000, ISBN 978-3-8085-5450-0, S. 171.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Erwin Riedel: Anorganische Chemie. Walter de Gruyter, 2004, ISBN 3-11-018168-1, S. 826 (eingeschränkte Vorschau in der Google-Buchsuche).
- Arnold F. Holleman, Nils Wiberg: Lehrbuch der Anorganischen Chemie, 102. Auflage, de Gruyter, Berlin 2007, S. 1654.
- Horst Briehl: Chemie der Werkstoffe. Springer, 2007, ISBN 3-8351-0223-0, S. 111 (eingeschränkte Vorschau in der Google-Buchsuche).
- Udo Schwertmann, Rochelle M. Cornell: Iron Oxides in the Laboratory. John Wiley & Sons, 2000, ISBN 978-3-527-29669-9, S. 10 (books.google.de).