Dulong-Petit-Gesetz
Das Dulong-Petit-Gesetz (nach Pierre Louis Dulong und Alexis Thérèse Petit) besagt, dass die molare Wärmekapazität eines aus einzelnen Atomen zusammengesetzten Festkörpers einen universalen und konstanten Wert habe, nämlich das Dreifache der universellen Gaskonstante R:
Die beiden Namensgeber stellten experimentell fest, dass zahlreiche von ihnen untersuchte Substanzen praktisch dieselbe molare Wärmekapazität haben, und veröffentlichten 1819 die Vermutung, es handle sich hierbei um eine allgemeine Gesetzmäßigkeit. Die klassische statistische Thermodynamik (die noch keine Quanteneffekte kannte), fand später für die molare Wärmekapazität monoatomarer (das heißt aus gleichartigen Atomen aufgebauter) Festkörper tatsächlich den konstanten Wert . Auf größere Temperaturbereiche ausgedehnte Messungen und theoretische Untersuchungen unter Berücksichtigung quantenmechanischer Prinzipien zeigen jedoch, dass dieses Gesetz nur näherungsweise gültig ist.
Herleitung
Die Teilchen in einem Festkörper sind an ihre Plätze im Kristallgitter gebunden und führen Schwingungen um diese Mittelpositionen aus. Die Schwingung jedes Teilchens kann in erster Näherung als harmonischer Oszillator beschrieben werden. Nach dem Gleichverteilungssatz der klassischen statistischen Thermodynamik trägt jeder der drei Gitterschwingungsfreiheitsgrade jedes Teilchens (je einer in -, - und -Richtung) bei der Temperatur im Mittel die kinetische Energie
mit der Boltzmannkonstante .
Die potentielle Energie des harmonischen Oszillators ist eine homogene Funktion 2. Grades in der Auslenkung. Also folgt nach dem Virialsatz, dass die mittlere potentielle Energie gleich der mittleren kinetischen Energie ist:
Auf einen Schwingungsfreiheitsgrad entfällt daher im Mittel die Energie und auf ein Teilchen mit drei Freiheitsgraden für die Gitterschwingung die Energie . Ein Mol solcher Teilchen trägt also die Energie
mit
und die molare Wärmekapazität ist
mit
- die Stoffmenge
- die molare Wärmekapazität bei konstantem Druck
- die molare Wärmekapazität bei konstantem Volumen
- die molare innere Energie
- die molare Enthalpie.
Grenzen
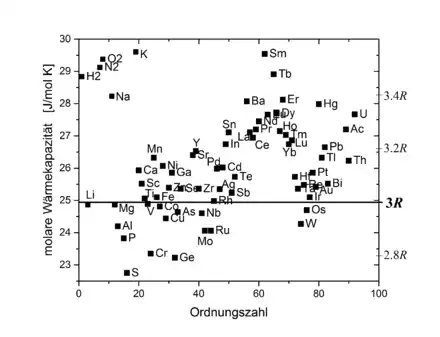
Trotz seiner Einfachheit macht das Dulong-Petit-Gesetz relativ gute Voraussagen für die spezifische Wärmekapazität von Feststoffen mit einfacher Kristallstruktur bei hinreichend hohen Temperaturen (z. B. bei Raumtemperatur).
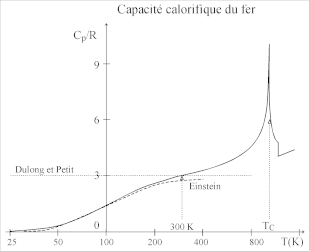
In Bereichen niedriger Temperaturen weicht es zunehmend von den experimentellen Befunden ab. Da die Gitterschwingungen quantisiert sind, können sie pro Freiheitsgrad nur Energiequanten der Größe aufnehmen ( Plancksches Wirkungsquantum, Schwingungsfrequenz). Insbesondere ist mindestens die Energie pro Freiheitsgrad nötig, um die Schwingung überhaupt anzuregen. Ist die zur Verfügung stehende thermische Energie zu gering, so werden einige Freiheitsgrade gar nicht angeregt und können nicht durch Energieaufnahme zur Wärmekapazität beitragen. Die Wärmekapazität von Festkörpern nimmt daher bei sehr niedrigen Temperaturen merklich ab und strebt für gegen Null (Dritter Hauptsatz der Thermodynamik). Hier liefert das Debye-Modell bessere Voraussagen.
Ist ein Festkörper nicht aus einzelnen Atomen, sondern aus komplizierteren Molekülen aufgebaut (z. B. CaSO4), so kommen zu den 3 Freiheitsgraden der Gitterschwingung für jedes Teilchen zusätzliche Freiheitsgrade der Molekülschwingung hinzu (die Teilchen des Moleküls schwingen gegeneinander). Die molare Wärmekapazität eines solchen Festkörpers kann deutlich höher sein als vom Dulong-Petit-Gesetz vorhergesagt.
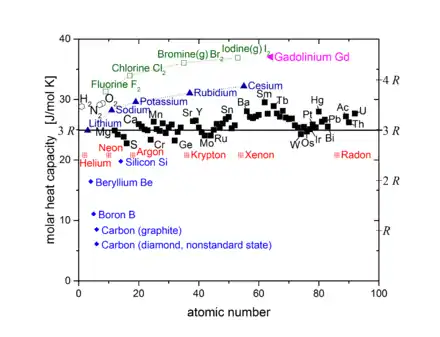
Metalle als monoatomare Festkörper befinden sich meist in guter Übereinstimmung mit dem Dulong-Petit-Gesetz. Wegen der Metallbindung würde man zunächst anderes erwarten, da die Atome bei ihrer Bindung Elektronen aus ihrer äußeren Elektronenhülle abgeben, welche sich frei durch den Kristall bewegen können (Elektronengas). Jedes Elektron müsste 3 Translationsfreiheitsgrade beitragen, so dass, wenn jedes Atom ein Elektron abgibt, die molare Wärmekapazität betragen müsste. Da im Elektronengas aber bereits alle Zustände unterhalb der Fermi-Verteilung besetzt sind, können die meisten Elektronen nicht in einen Zustand höherer Energie übergehen und daher auch nicht zur Wärmekapazität beitragen.
Literatur
- Alexis Petit, Pierre Louis Dulong: Recherches sur quelques points importants de la théorie de la chaleur. Présentées à l'Académie des sciences le 12 avril 1819. In: Joseph Louis Gay-Lussac, François Arago (Hrsg.): Annales de chimie et de physique. Band 10. Crochard, Paris 1819, S. 395–413 (französisch, online bei Gallica – Bibliothèque Nationale de France [abgerufen am 4. Dezember 2016] englische Übersetzung online beim Le Moyne College): « reconnaitre immédiatement l'existence d'une loi physique susceptible d'être généralise et étendue à toutes substances élementaires [...] Les atomes de tous le corps simples ont exactement la même capacité pour la chaleur. »