Dolichodial
Dolichodial ist ein monocyclisches Monoterpen mit zwei Aldehydgruppen, welches zur Gruppe der Iridoide gehört.
| Strukturformel | |||||||
|---|---|---|---|---|---|---|---|
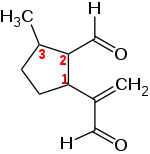 | |||||||
| Strukturformel ohne Stereochemie | |||||||
| Allgemeines | |||||||
| Name | Dolichodial | ||||||
| Andere Namen |
| ||||||
| Summenformel | C10H14O2 | ||||||
| Externe Identifikatoren/Datenbanken | |||||||
| |||||||
| Eigenschaften | |||||||
| Molare Masse | 166,22 g·mol−1 | ||||||
| Aggregatzustand |
flüssig[1] | ||||||
| Siedepunkt | |||||||
| Sicherheitshinweise | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||
Dolichodial und dessen Stereoisomere findet sich im ätherischen Öl bestimmter Pflanzen, aber auch in den Wehrsekreten einiger Insektenarten.
Isomere
Dolichodial hat in seinem Fünfring drei Stereozentren. Möglich sind daher vier diastereomere Enantiomerenpaare. Als Dolichodial wird die (1S,2R,3S)-konfigurierte Verbindung und ihr spiegelbildliches Isomer mit (1R,2S,3R)-Konfiguration bezeichnet.
| Isomere von Dolichodial | ||
| Name | (1S,2R,3S)-(–)-Dolichodial (A) | (1R,2S,3R)-(+)-Dolichodial (A′) |
| Strukturformel | -(%E2%80%93)-Dolichodial_Stereoisomer_A_V.1.svg.png.webp) |
-(%252B)-Dolichodial_Stereoisomer_A_V.1.svg.png.webp) |
| CAS-Nummer | 60478-52-6 | 1198-22-7 |
| 5951-57-5 (unspez.) | ||
| PubChem | 534263 | – |
| – (unspez.) | ||
| Wikidata | Q108782261 | – |
| Q1235560 (unspez.) | ||
Vorkommen und Verwendung
Dolichodial (A) wurde 1960 erstmals aus Drüsenameisen der Gattungen Dolichoderus und Iridomyrmex isoliert.[3] Erst sechzehn Jahre später fand man es auch in einer Pflanze, dem Katzen-Gamander Teucrium marum, als wesentlicher Bestandteil des ätherischen Öls.
Verwandte Verbindungen
Die Paare mit einer von Dolichodial abweichenden Stereochemie werden als Anisomorphal und Peruphasmal bezeichnet.
| Isomere von Anisomorphal und Peruphasmal | ||||
| Name | (1S,2S,3S)-(+)-Anisomorphal (B) | (1R,2R,3R)-(–)-Anisomorphal (B′) | (1R,2R,3S)-Peruphasmal (C) | (1S,2S,3R)-Peruphasmal (C′) |
| Andere Namen | trans-(+)-Dolichodial | |||
| Strukturformel | -(%252B)-Anisomorphal_Stereoisomer_B_V.1.svg.png.webp) |
-(%E2%80%93)-Anisomorphal_Stereoisomer_B_V.1.svg.png.webp) |
-Peruphasmal_Stereoisomer_C_V.1.svg.png.webp) |
-Peruphasmal_Stereoisomer_C_V.1.svg.png.webp) |
| CAS-Nummer | 3671-76-9 | – | 913835-25-3 | – |
| 1127-66-8 (Anisomorphal, unspez.) | 1127-67-9 (Peruphasmal, unspez.) | |||
| 864826-30-2 (epi-Dolichodial, unspez.) | ||||
| PubChem | 76970747 | – | – | – |
| – (unspez.) | ||||
| Wikidata | Q27259133 | – | – | – |
| Q97483975 (unspez.) | ||||
In der Natur kommt häufig noch das zu Dolichodial C-2-epimere (+)-Anisomorphal (B) vor, das auch als trans-(+)-Dolichodial bezeichnet wurde. A′ bis D′ sind die zu A bis D spiegelbildlichen Verbindungen (Enantiomere).
Das Anisomorphal (B) wurde 1962 beschrieben als Hauptkomponente des Wehrsekrets der Gespenstschrecke Anisomorpha buprestoides. In kleineren Mengen findet es sich ebenfalls im Katzengamander. Das Peruphasmal (C)[4] hat seinen Namen von der Gespenstschrecke Peruphasma schultei, die dieses Stereoisomer als Hauptkomponente in ihrem Wehrsekret nutzt. Neuere Untersuchungen zeigen, dass A. buprestoides neben Anisomorphal auch Peruphasmal und Dolichodial im Wehrsekret verwendet. Dabei kann in Abhängigkeit von der geographischen Herkunft, vom Alter des Tiers und von individuellen Gegebenheiten eine der drei Verbindungen dominieren. Geschlechtsreife Tiere erzeugen fast ausschließlich Peruphasmal. Ausschließlich Dolichodial findet sich im Wehrsekret der Larven einiger Arten der Blattwespen der Gattung Craesus.[5] Der Fransenflügler Callococcithrips fuscipennis nutzt als Wehrsekret ein Gemisch, welches neben Alkanen und Estern auch Dolichodial und eine weitere Substanz enthält, die möglicherweise dem Stereoisomer D oder D′ des Dolichodials entspricht,[6] die sonst bisher noch nicht in der Natur gefunden wurden.
-Stereoisomer_D_V.1.svg.png.webp) (1R,2S,3S)-Stereoisomer (D)
(1R,2S,3S)-Stereoisomer (D)-Stereoisomer_D_V.1.svg.png.webp) (1S,2R,3R)-Stereoisomer (D′)
(1S,2R,3R)-Stereoisomer (D′)
Einzelnachweise
- Connolly/Hill: Dictionary of Terpenoids. CRC Press, 1991, ISBN 978-0-412-25770-4, S. 47 (books.google.de).
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- G. W. K. Cavill: Insect terpenoids and nepetalactone. In: W. I. Taylor, A. R. Battersby (Hrsg.): Cyclopentanoid terpene derivatives. Dekker, New York 1969, S. 203–238.
- A. T. Dossey, S. Walse, A. S. Edison: Developmental and geographical variation in the chemical defense of the walkingstick insect Anisomorpha buprestoides. In: Journal of Chemical Ecology. 34, 2008, S. 584–590, doi:10.1007/s10886-008-9457-8.
- J. L. Boevé, J. C. Braekman, D. Daloze, M. Houart, J. M. Pasteels: Defensive secretions of Nematinae larvae (Symphyta – Tenthredinidae). In: Cellular and Molecular Life Sciences (CMLS). 40, 1984, S. 546–547, doi:10.1007/BF01982322.
- G. Tschuch, P. Lindemann, G. Moritz: An unexpected mixture of substances in the defensive secretion of the Tubuliferan thrips, Callococcus fuscipennis. In: Journal of Chemical Ecology. 34, 2008, S. 742–747, doi:10.1007/s10886-008-9494-3.