Doebner-Reaktion
Die Doebner-Reaktion oder Doebner-Chinolinsynthese ist eine Namensreaktion der Organischen Chemie.[1] Sie wurde erstmals 1887 von Oskar Gustav Doebner (1850–1907) als Synthese von Säure-Derivaten des Chinolins beschrieben.[1][2] Im Gegensatz zur Synthese von Säure-Derivaten des Chinolins nach Pfitzinger erfolgt die Synthese nach Doebner ausgehend von Brenztraubensäure, einem Aldehyd und Anilin.[3][4]
Übersichtsreaktion
Entsprechend der verwendeten Edukte Brenztraubensäure und dem Aldehyd handelt es sich bei dem abschließenden Reaktionsprodukt um eine α,β-ungesättigte Carbonsäure (mit der grau markierten Struktur entspricht die α,β-ungesättigte Carbonsäure dem anschließend angeführten Reaktionsprodukt der Doebner-Reaktion):[4]
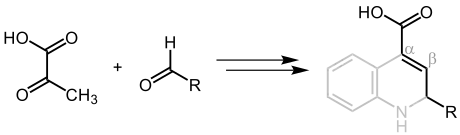
In Anbetracht der Durchführung Doebners mit Anilin, handelt es sich bei dem Produkt um ein Derivat des Chinolins, spezieller um eine Chinolin-4-carbonsäure:[4]

Reaktionsmechanismus
Der Reaktionsmechanismus ist nicht genau bekannt, hier werden zwei Vorschläge aufgeführt.[1] Eine Möglichkeit ist die zunächst vonstatten gehende Aldolkondensation, ausgehend von der Enol-Form der Brenztraubensäure (1) und dem Aldehyd, unter Bildung einer β,γ-ungesättigten α-Ketocarbonsäure (2).[1] Gefolgt von einer Michael-Addition mit Anilin bildet sich ein Anilin-Derivat (3). Nach der Cyclisierung am Benzolring und zwei Protonenverschiebungen entsteht unter Wasserabstaltung die Chinolin-4-carbonsäure (4):[1]

Ein alternativer Mechanismus beschreibt ausgehend vom Anilin und dem Aldehyd unter Wasserabspaltung die Bildung der Schiff'schen Base.[1] Die anschließende Reaktion mit der Enol-Form der Brenztraubensäure (1) führt zur Bildung des eben erwähnten Anilinderivats (3) und der Fortführung des bereits beschriebenen Reaktionsmechanismus:[1]

Konkurrenzreaktion
Der Literatur lässt sich entnehmen, dass die Doebner-Reaktion im Fall der Reaktion von 2-Chlor-5-aminopyridin versagt.[5] Die Cyclisierung würde in diesem Fall an der Aminogruppe anstelle des Benzolrings erfolgen und zu einem Derivat des Pyrrolidins führen.[5]
Atomökonomie
Die Atomeffizienz dieser Reaktion lässt sich als verhältnismäßig gut einstufen. Es fallen keine höhermolekularen Nebenprodukte an und selbst auf niedermolekularer Ebene spaltet sich im Lauf der Reaktion lediglich Wasser ab. Zu beachten wäre an dieser Stelle inwiefern die Edukte vollständig umgesetzt werden. Da der Ablauf der vorgestellten Mechanismen über die Enol-Form der Brenztraubensäure erfolgt, welche gegenüber der Keto-Form im Allgemeinen nicht überwiegt, wäre ein Rückstand des Eduktes Brenztraubensäure zu erwarten. Ein gänzlicher Stoffumsatz wäre demnach nicht gegeben, was die Effizienz dieser Reaktion senkt.
Siehe auch
Alternative Synthesen von Chinolinderivaten sind beispielsweise die Combes-Chinolinsynthese, die Conrad-Limpach-Chinolinsynthese und die Pfitzinger-Reaktion für die Synthese von Säure-Derivaten des Chinolins.[1][3]
Einzelnachweise
- Daniel Zerong Wang: Comprehensive Organic Name Reactions and Reagents. Band 1. John Wiley & Sons, Inc., John Wiley & Sons, Inc., Hoboken, New Jersey 2009, ISBN 978-0-471-70450-8, S. 921–923, doi:10.1002/9780470638859.conrr197.
- Rudolf Pummerer: Doebner. In: Neue Deutsche Biographie. Band 4, Duncker & Humblot, Berlin 1959, ISBN 3-428-00185-0, S. 13–14.
- W. Pfitzinger: Chinolinderivate aus Isatinsäure. In: Journal für Praktische Chemie. Band 33, Nr. 1, 1886, S. 100, doi:10.1002/prac.18850330110.
- Oscar Doebner: Ueber α-Alkylcinchoninsäuren und α-Alkylchinoline. In: Justus Liebigs Annalen der Chemie. Band 242, Nr. 3, 1887, S. 265–388, doi:10.1002/jlac.18872420302.
- Martin J. Weiss, Charles R. Hauser: Failure of the Doebner Reaction with 2-Chloro-5-aminopyridine. Synthesis of a Pyrrolidine Derivative. In: Journal of the American Chemical Society. Band 68, Nr. 4, 1946, S. 722–723, doi:10.1021/ja01208a513.