Diphthamid
Diphthamid ist eine von Histidin abgeleitete Aminosäure, die nur bei einem Schritt der Elongation in der Proteinbiosynthese eine Rolle spielt. Weitere biologische Funktionen und ein Vorkommen außerhalb der Proteinbiosynthese sind nicht bekannt. Der Name leitet sich vom Diphtherietoxin ab, dessen Hemmwirkung am Diphthamid ansetzt.[2] Die vergleichbaren Toxine Exotoxin A und Choleratoxin wirken ebenfalls am Diphthamid.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
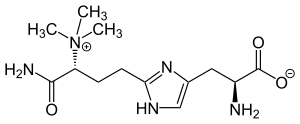 | ||||||||||||||||
| L-Diphthamid | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Diphthamid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C13H23N5O3 | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 297,35 g·mol−1 | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Bei der Elongation in Eukaryoten und Archaeen enthält der dabei nötige Elongationsfaktor 2 (EF-2) in seiner Peptidkette an einer Position statt der Aminosäure Histidin das davon abgeleitete Diphthamid. Die Biosynthese ist komplex, es sind mindestens sieben Proteine daran beteiligt.[3] Im Verlauf der Biosynthese wird das Histidin in der in die Peptidkette eingebauten Form zum Diphthamid modifiziert.[4]
Die 3-Amino-3-Carboxypropylgruppe aus S-Adenosylmethionin wird dabei als Radikal auf das Histidin übertragen.[5] Anschließend katalysiert eine Methyltransferase die Trimethylierung und eine Synthase eine Amidierung.[6][7]
Einzelnachweise
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Rolf Knippers: Molekulare Genetik. Georg Thieme Verlag, 2006, ISBN 978-3-13-477009-4, S. 445 (eingeschränkte Vorschau in der Google-Buchsuche).
- Daniel Ladant: The Comprehensive Sourcebook of Bacterial Protein Toxins. Academic Press, 2005, ISBN 978-0-08-045698-0, S. 250 (eingeschränkte Vorschau in der Google-Buchsuche).
- Biosynthese in Backhefe
- Damien M. Murphy: Electron Paramagnetic Resonance. Royal Society of Chemistry, 2010, ISBN 978-1-84755-061-3, S. 138 (eingeschränkte Vorschau in der Google-Buchsuche).
- Georges N. Cohen: Microbial Biochemistry. Springer Science & Business Media, 2011, ISBN 978-90-481-9437-7, S. 407 (eingeschränkte Vorschau in der Google-Buchsuche).
- S. Liu, G. T. Milne u. a.: Identification of the proteins required for biosynthesis of diphthamide, the target of bacterial ADP-ribosylating toxins on translation elongation factor 2. In: Molecular and cellular biology. Band 24, Nummer 21, November 2004, S. 9487–9497, ISSN 0270-7306. doi:10.1128/MCB.24.21.9487-9497.2004. PMID 15485916. PMC 522255 (freier Volltext).