Deacon-Verfahren
Als Deacon-Verfahren wird die Herstellung von Chlor durch Oxidation von Chlorwasserstoff mit Sauerstoff bezeichnet. Das Verfahren wurde vom englischen Chemiker Henry Deacon (1822–1876) im Jahre 1868 zum Patent angemeldet.
Geschichte
Vor allem das 1792 eingeführte Leblanc-Verfahren zur Soda-Herstellung und die nachfolgende starke Entwicklung der chemischen Industrie führte zu massivem Anfall von Chlorwasserstoff, der entweder direkt in die Luft oder in Wasser gelöst als Salzsäure in das Abwasser abgegeben wurde. In den sechziger Jahren des 18. Jahrhunderts traten daher mehrere Gesetze in Kraft, in denen die ungezielte Abgabe von Chlorwasserstoffgas bzw. Salzsäure stark eingeschränkt wurde. Henry Deacon gelang mit seiner Erfindung ein Durchbruch in doppeltem Sinne, zum einen wurde das Umweltproblem mit Chlorwasserstoff gelöst und zum anderen wurde ein wertvoller Stoff gewonnen, der sich beispielsweise als Chlorkalk gut verkaufen ließ.
Chemie
Das klassische (einstufige) Deacon-Verfahren ist die Umsetzung von HCl-Gas mit Sauerstoff (Luft oder reiner Sauerstoff) entsprechend folgender Reaktionsgleichung:[1]
Die Reaktion ist exotherm mit einer Reaktionsenthalpie von −114,8 kJ/mol und ist eine Gleichgewichtsreaktion, d. h. die Umsetzung verläuft nicht vollständig.
Die Umsetzung erfolgt bei Temperaturen von ca. 400–450 °C an festen („heterogenen“) Katalysatoren auf der Basis von CuCl2 bzw. CuSO4. Im folgenden Bild ist der Gleichgewichtsumsatz von 4 Mol HCl mit einem Mol O2 in Abhängigkeit von der Temperatur dargestellt (bei Normaldruck):
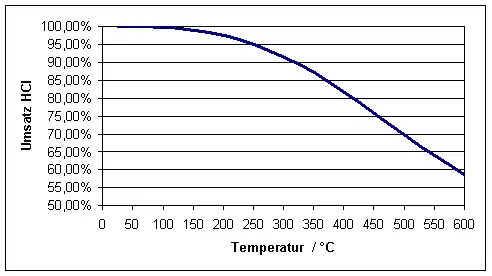
Zur Erzielung eines hohen Umsatzes an Chlorwasserstoff wäre eine niedrigere Reaktionstemperatur günstiger, jedoch ist hier bei den verwendeten Katalysatoren auf Basis von Kupfer die Reaktionsgeschwindigkeit zu gering. Der Gleichgewichtsumsatz an HCl lässt sich noch durch Druckerhöhung und Erhöhung des Sauerstoff-Überschusses erhöhen, ein vollständiger oder nahezu vollständiger Umsatz wird bei 400–450 °C Reaktionstemperatur aber dadurch nicht erreicht.
Technische Umsetzung
Die chemische Reaktion erscheint einfach, jedoch ist die technische Realisierung mit derart massiven Problemen verbunden, dass sich dieser Prozess bis heute nicht großtechnisch zur Chlorproduktion bzw. zur Recycling von Chlorwasserstoff durchsetzen konnte. Als technische Probleme treten vor allem Korrosion und die Handhabung des Katalysators in einem Reaktor auf:
- Korrosion tritt vor allem bei der Abkühlung des aus dem Reaktor austretenden Gasgemisches (HCl, O2, Cl2, H2O) an metallischen Oberflächen auf.
- Der Katalysator auf Basis Kupfer wird während der Reaktion intermediär auch zu CuCl, CuO und CuO2 umgewandelt bzw. steht mit diesen Verbindungen in einem Gleichgewicht. Speziell CuCl mit seinem niedrigen Schmelzpunkt von ca. 430 °C und seiner Eigenschaft zur Sublimation, d. h. zum Verdampfen aus der festen Phase, sorgt zum Verkleben des Katalysators im Reaktor und zum Austrag des Katalysators mit den Reaktionsgasen aus dem Reaktor.
Formal kann man die einstufige Reaktion in zwei Teilstufen trennen, bei dem zunächst CuO mit HCl zu CuCl2 und Wasser umgesetzt wird, welches anschließend in einer zweiten Reaktion zu Chlor und CuO oxidiert wird:
Diese Trennung der Reaktion ermöglichte es, das technische Verfahren in zwei getrennten Reaktoren durchzuführen, wobei man die Reaktionstemperaturen nun für jede Einzelreaktion optimal wählen kann. Auch ist diese zweistufige Reaktion keine Gleichgewichtsreaktion mehr, so dass die Problematik der Gastrennung der Produktgase und der Korrosion bei der Produktaufarbeitung reduziert wird. Theoretisch arbeitet der erste Reaktor nur mit den Gasen HCl und H2O in der Reaktion, der zweite nur mit O2 (bzw. Luft) und Chlor.
Jedoch ist auch hiermit kein technischer Durchbruch erzielt worden, da der mechanische Transport des Katalysators von einem Reaktor in einen anderen und wieder zurück alles andere als trivial ist. Auch lassen sich die Reaktionen nicht vollständig voneinander trennen, so dass die eigentlichen Probleme zwar reduziert, aber nicht vollständig behoben wurden.
Technische Weiterentwicklungen
In der Folgezeit, bis in die jüngste Vergangenheit, wurden Forschungen zu diesem Verfahren durchgeführt, sowohl zur Entwicklung von verbesserten Katalysatorsystemen als auch zur besseren technischen Realisierung. Daraus entstanden mehrere Varianten bzw. Weiterentwicklungen des Deacon-Verfahrens, welche teilweise großtechnisch realisiert wurden:
- Shell-Chlor-Verfahren der Fa. Shell
- MT-Chlor Verfahren der Mitsui-Toatsu Chemicals, heute Mitsui Chemicals (Japan)
- KEL-Chlor-Verfahren der M. W. Kellogg und DuPont[2]
- Carrier Catalyst Process der USC (University of Southern California)
- Sumitomo-Chlor-Verfahren der Sumitomo Chemicals (Japan)
Literatur
- Henry Deacon: XXIX.—On Deacon's method of obtaining chlorine, as illustrating some principles of chemical dynamics. In: J. Chem. Soc. Band 25, 1872, S. 725–767, doi:10.1039/JS8722500725.
- Robert Hasenclever: Ueber Chlorbereitung nach Deacon. In: Berichte der deutschen chemischen Gesellschaft. Band 9, Nr. 2, 1876, S. 1070–1073, doi:10.1002/cber.18760090211.
- Patent US85370: Manufacture of Chlorine. Veröffentlicht am 29. Dezember 1868, Erfinder: Henry Deacon.
- Patent US165802: Improvement in manufacture of chlorine. Veröffentlicht am 20. Juli 1875, Erfinder: Henry Deacon.
Einzelnachweise
- Erwin Riedel, Christoph Janiak: Anorganische Chemie. 9. Auflage. de Gruyter, Berlin / Boston 2015, ISBN 978-3-11-035528-4, S. 429 (eingeschränkte Vorschau in der Google-Buchsuche).
- Armin Müller, Karl Heinz Buchel, Peter Fröhlich, Martin Bertau, Michael Katzberg, Dietmar Werner, Hans-Heinrich Moretto: Industrielle Anorganische Chemie. 4. Auflage. Wiley-VCH, Weinheim 2013, ISBN 978-3-527-64958-7 (eingeschränkte Vorschau in der Google-Buchsuche).