Cytochrom P450 27B1
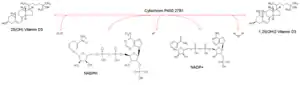
Das Cytochrome P450, Familie 27, Subfamilie B, Polypeptid 1 (kurz: CYP27B1 oder herkömmlich: 1α-Hydroxylase) ist ein Mitglied der Cytochrom P450-Enzym-Superfamilie. Es hydroxyliert das Prohormon 25(OH)Vitamin D3 zu 1,25(OH)2Vitamin D3 und aktiviert es so. Die 1α-Hydroxylase konkurriert mit der 24-Hydroxylase um das 25(OH)D3, welche das Prohormon inaktiviert. Beide Enzyme sind gegenläufig reguliert.
| Cytochrom P450 27B1 | ||
|---|---|---|
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | < 508 Aminosäuren | |
| Kofaktor | Häm-Thiolat | |
| Bezeichner | ||
| Gen-Name | CYP27B1 | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 1.14.13.13, Oxygenase | |
| Reaktionsart | Addition eines Sauerstoffatoms | |
| Substrat | 25(OH)Vitamin D3, NADPH, H+, O2 | |
| Produkte | 1,25(OH)2Vitamin D3, NADP+, H2O | |
Genetik
Das codierende Gen liegt im Chromosomenabschnitt 12q12.1-q13.3. Ein Defekt dieses Gens führt zu der Vitamin-D-abhängigen Rachitis Typ 1 (siehe Rachitis), die mit dem Enzymprodukt Calcitriol 1,25(OH)2D3 (1,25-Dihydroxycholecalciferol, auch Vitamin-D3-Hormon) therapiert werden muss.
Vorkommen
Die 1α-Hydroxylase kommt hauptsächlich an der Außenseite der Mitochondrien-Zellmembran der Niere, daneben aber noch in vielen anderen Organen und Geweben vor: Prostata, Brust, Darm, Lunge, Inselzellen der Bauchspeicheldrüse, Monozyten, Zellen der Nebenschilddrüse, Hautzellen. Unter normalen Umständen trägt vor allem die Niere zum im Blut zirkulierenden Calcitriol (1,25(OH)2D3) bei (Ausnahmen: Schwangerschaft, chronisches Nierenversagen, Sarkoidose, Tuberkulose, Rheumatoide Arthritis). Das außerhalb der Niere produzierte 1,25(OH)2D3 ist dagegen vor allem ein lokal begrenzt wirksamer (autokriner/parakriner) Faktor für zellspezifische Funktionen.[1]
Regulation
- In der Niere: Die Aktivität der 1α-Hydroxylase in den Nieren ist streng reguliert: Aktiviert wird sie durch verminderte Calciumaufnahme mit der Nahrung einerseits direkt über eine Verminderung des Serum-Calciums und andererseits indirekt über eine Erhöhung des Parathormons. Aktiviert wird sie ebenfalls über eine verminderte Phosphataufnahme mit der Nahrung, was indirekt durch ein vermittelndes Hormon geschieht (welches Hormon ist noch nicht sicher). Gehemmt wird sie durch ihr Produkt, das 1,25(OH)2D3 selber, einerseits direkt und andererseits durch eine Hemmung der Parathormonaktivität.
Eine chronische Niereninsuffizienz kann zu P450 28B1-Mangel und durch den daraus resultierenden 1,25(OH)2D3-Mangel zu einer sogenannten „renalen Rachitis“ führen.
- In Geweben außerhalb der Niere: ist die Regulation anders. Hier ist die Rate der 1,25(OH)2D3-Produktion vor allem abhängig von lokal wirksamen Faktoren wie z. B. Zytokinen, Wachstumsfaktoren. Die entsprechenden Mechanismen sind noch nicht vollständig verstanden. Liu et al. zeigten 2006, dass Aktivierung von Makrophagen über das TLR (Toll Like Receptor) ebenfalls zu einer Produktion von 1,25(OH)2D3 führt. Das Mechanismus dient der Produktion von körpereigene Bakteriziden (Cathelicidin), die wiederum mit Hilfe des VDR Rezeptors reguliert wird.[1][2]
Siehe auch
- Cholecalciferol: Der Weg des Vitamin D bis zur 1α-Hydroxylase.
- Calcitriol: Die Wirkungen des aktivierten Vitamin D.
Weblinks
- Jassal, D’Eustachio: Further hydroxylation of calcidiol in kidney to form calcitriol. reactome.org
- PT Liu, S Stenger, H Li et al.: Toll-like receptor triggering of a vitamin D-mediated human antimicrobial response. In: Science. 311, Nr. 5768, März 2006, S. 1770–3. doi:10.1126/science.1123933. PMID 16497887.
- Paul R. Ortiz de Montellano: Cytochrome P450. Springer Science & Business Media, 2005, ISBN 0-306-48324-6 S. 460 (eingeschränkte Vorschau in der Google-Buchsuche).
Einzelnachweise
- AS Dusso, AJ Brown, E Slatopolsky: Vitamin D. In: Am. J. Physiol. Renal Physiol.. 289, Nr. 1, Juli 2005, S. F8–28. doi:10.1152/ajprenal.00336.2004. PMID 15951480.
- PT Liu, S Stenger, H Li et al.: Toll-like receptor triggering of a vitamin D-mediated human antimicrobial response. In: Science. 311, Nr. 5768, März 2006, S. 1770–3. doi:10.1126/science.1123933. PMID 16497887.