Cyclohexadienone
Cyclohexadienone sind eine Gruppe chemischer Verbindungen, die eine 2,4-Cyclohexadienon- oder eine 2,5-Cyclohexadienon-Teilstruktur aufweisen. Es handelt sich um cyclische konjugierte, bzw. kreuzkonjugierte Enone. Die beiden unsubstituierte Verbindungen 2,4-Cyclohexadienon und 2,5-Cyclohexadienon sind thermodynamisch instabil.[1]
| Cyclohexadienone | |
|---|---|
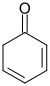 |
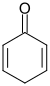 |
| 2,4-Cyclohexadienon | 2,5-Cyclohexadienon |
Keto-Enol-Tautomerie
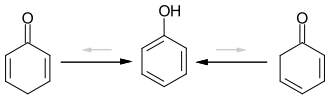
Die unsubstituierten Cyclohexadienone werden über eine Keto-Enol-Tautomerie vollständig in die aromatische Verbindung Phenol überführt.[2] Dies gilt auch für 2,4-Cyclohexadienon-Derivate mit mindest einem H-Atom in 6-Stellung, bzw. für 2,5-Cyclohexadienon-Derivate mit mindest einem H-Atom in der 4-Position.
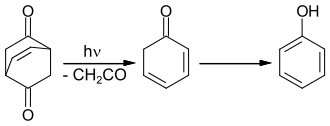
Durch eine Retro-Diels-Alder-Reaktion bei 800 °C (Blitzthermolyse) im Vakuum und Abfangen der Produkte im Kryostat bei −196 °C lässt sich die Bildung von 2,4- und 2,5--Cyclohexadienon nachweisen.[3]
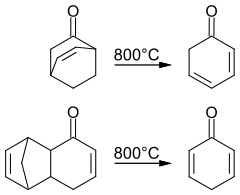
Bestrahlt man Bicyclo[2.2.2]oct-7-en-2,5-dion, so bildet sich Phenol.[4] Es kann gezeigt werden, dass diese Reaktion über 2,5-Cyclohexadienon als Zwischenstufe verläuft. Die Kinetik der Tautomerisierung zu Phenol lässt sich mit der Blitzlichtphotolyse untersuchen.[1]
Cyclohexadienone als Zwischenprodukte
Bereits 1901 wurden von Arthur Lapworth die Cyclohexadiene als Zwischenprodukte bei der elektrophilen Substitution in Betracht gezogen.[5] Dies konnte 1974 für die Bromierung von Phenolderivaten in einer wässrigen Lösung mit Essigsäure und Natriumacetat nachgewiesen werden.[6]
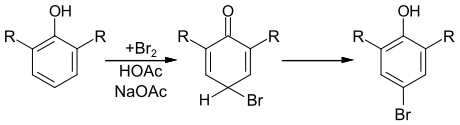
Während die Umlagerung des unsubstituierten 4-Brom-2,5-cyclohexadienon (R=H) sehr schnell verläuft, ist das Cyclohexadienderivat, das man bei der Umsetzung von 2,6-Di-tert-butylphenol (R=t-Bu) erhält, ausreichend stabil, um es isolieren zu können.
Disubtituierte Cyclohexadienone
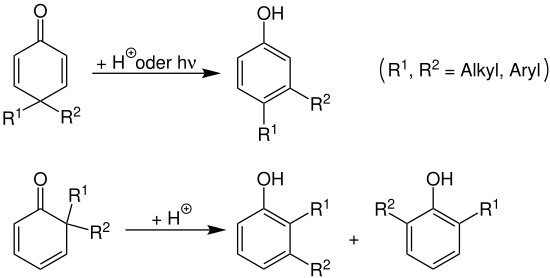
2,4-Cyclohexadienon mit zwei Substituenten in der 6-Position, bzw. 2,5-Cyclohexadienon mit zwei Substituenten in der 4-Position können nicht mehr durch eine Keto.Enol-Tautomerisierung rearomatisieren. Dies kann jedoch in saurer Lösung oder photochemisch in einer Dienon-Phenol-Umlagerung erfolgen:[7]
Einzelnachweise
- Marco Capponi, Ivo Gut, Jakob Wirz: Das Gleichgewicht Phenol ⇌ 2,4-Cyclohexadienon in wäßriger Lösung. In: Angewandte Chemie. Band 98, Nr. 4, April 1986, S. 358, doi:10.1002/ange.19860980422.
- Joachim Buddrus: Grundlagen der Organischen Chemie. Walter de Gruyter, Berlin, New York 1980, ISBN 3-11-004030-1, S. 467.
- Marie-Claire Lasne, Jean-Louis Ripoll, Jean-Marc Denis: Reactions retrodieniques - X Obtention par reaction de retro-diels-alder de cetones tautomeres de phenols. In: Tetrahedron Letters. Band 21, Nr. 5, Januar 1980, S. 463, doi:10.1016/s0040-4039(00)71433-x.
- Peter H. Schippers, Harry P. J. M. Dekkers: Asymmetric photodestruction of bicyclo[2.2.2]oct-2-ene-5,7-dione: absolute configuration and n-π* excited state geometry. In: J. Chem. Soc., Perkin Trans. 2. Nr. 11, 1982, S. 1429, doi:10.1039/p29820001429.
- Arthur Lapworth: CXXXIV.—The form of change in organic compounds, and the function of the α-meta-orientating groups. In: J. Chem. Soc., Trans. Band 79, Nr. 0, 1901, S. 1265, doi:10.1039/ct9017901265.
- Peter B. D. De la Mare: Pathways in electrophilic aromatic substitutions. Cyclohexadienes and related compounds as intermediates in halogenation. In: Accounts of Chemical Research. Band 7, Nr. 11, 1. November 1974, S. 361, doi:10.1021/ar50083a001.
- Zerong Wang: Comprehensive organic name reactions and reagents Volume 1. John Wiley, Hoboken 2009, ISBN 978-0-470-28662-3, S. 897–899.