Kreuzkonjugation
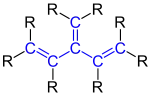
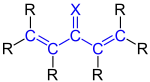
Als Kreuzkonjugation (engl. cross-conjugation) wird in der Organischen Chemie eine besondere Art der Konjugation von Doppelbindungen bezeichnet. Dazu müssen mindestens drei über Einfachbindungen miteinander verknüpfte Doppelbindungen vorhanden sein. Eine davon muss eine gabelförmige Verzweigung aufweisen (Beispiele siehe unten). Dies ist die „klassische“ Definition. Eine weitere beruht auf einer speziellen MO-Theorie (PMO-Methode nach Dewar).[1]
| Prinzip kreuzkonjugierter Doppelbindungen |
 |
 |
Gekreuzt-konjugierte Doppelbindungssysteme
Nachdem in der Organischen Chemie gegen Ende des 19. Jahrhunderts Klarheit über die Konstitution der wichtigsten „ungesättigten“ Verbindungen erreicht worden war, blieb es rätselhaft, wie Konstitution und Farbe organischer Substanzen zusammenhingen.[2] So war z. B. 1,4-Benzochinon oder Phoron gelb, während andere Ketone, wie Aceton oder Acetophenon keine Farbe zeigten.
.svg.png.webp)
Johannes Thiele berichtete im Jahre 1900 über Reaktionen von Cyclopentadien mit verschiedenen Ketonen, bei der ungesättigte Kohlenwasserstoffe entstanden, die er „wegen der leuchtenden Farbe“ Fulvene nannte (lat. fulvus, braungelb, rotgelb). Thiele sah darin einen Beweis, „dass die Färbung organischer Verbindungen im Wesentlichen durch die Art der Anordnung von Doppelbindungen bedingt ist.“
Für diese spezielle Anordnung der Doppelbindungen hat sich der Begriff „gekreuzt-konjugiert“ eingebürgert. Der Begriff wurde und wird Thiele zugeschrieben. In seiner Mitteilung[3] kommt jedoch das Wort „gekreuzt“ nicht vor. In der zeitgenössischen Literatur findet es sich bei Hermann Staudinger[4] und Auers.[5]
Seitdem sind zahlreiche Moleküle mit dem Strukturelement „gekreuzt-konjugierte Doppelbindung“ entdeckt und synthetisiert worden.
Eine Erklärung des Zusammenhangs von Konstitution und Farbe wurde erst im 20. Jahrhundert durch die Quantenchemie möglich. Es wurde erkannt, dass es irreführend ist, die Farbe von Fulvenen und ungesättigten Carbonylverbindungen zu vergleichen; denn diese resultiert aus unterschiedlichen elektronischen Übergängen (elektronisch angeregten Zuständen), nämlich einem n-π*-Übergang (Chinon) bzw. π-π*-Übergang (Fulven).
Auswirkungen gekreuzt-konjugierter Doppelbindungen
Bewirkt die Anwesenheit gekreuzt-konjugierter Doppelbindungen in einem Molekül beobachtbare Effekte, und wenn ja, welche?
Zur Erklärung der Farbe, genauer: der Absorption von sichtbarem oder ultraviolettem Licht (UV/VIS-Spektrum, Elektronenspektrum), dürfte der Begriff Kreuzkonjugation heute entbehrlich sein.
Hat Kreuzkonjugation einen nennenswerten Einfluss auf die Struktur organischer Verbindungen, d. h. Bildungswärmen, Bindungslängen, Bindungswinkel oder Dipolmomente?
Phelan und Orchin legten 1968 eine Arbeit vor, in der sie den Kohlenwasserstoff 3-Methylen-1,4-pentadien unter dem Aspekt der VB-Theorie sowie der damals verfügbaren Hückel-Näherung (HMO-Modell) in der MO-Theorie untersuchten.[6] Dieser ungesättigte Kohlenwasserstoff kann als Prototyp der gekreuzt-konjugierten Systeme betrachtet werden, ist sozusagen ein „offenes Fulven“ (Staudinger[7]). Allerdings sind hier verschiedene Konformationen möglich, zwischen denen in der HMO-Näherung keine Unterscheidung möglich ist.
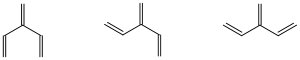
Phelan und Orchin fanden, dass die Hückelsche Resonanzenergie 0,900 β beträgt und die Bindungsordnung der C-1/C-2-Bindung höher sei als beim Referenzmolekül 1,3-Butadien. Für die Bindung C-3/C-6 (Verzweigung) sollte der „Doppelbindungscharakter“ geringer sein als beim 1,3-Butadien. Die Autoren kamen zu dem Schluss: "...in the ground state there is some net bonding or conjugation between the conjugated centers."
Experimentelle Daten zur Überprüfung dieser Voraussage scheinen nicht vorzuliegen. Das Molekül ist sehr labil.
Phelan und Orchin dehnten das Konzept der Kreuzkonjugation auf weitere Verbindungen aus, sogar Harnstoff. In diesem Fall werden die „freien“ (nicht-bindenden) Elektronenpaare an den Stickstoffatomen als Äquivalente einer C=C-π-Bindung betrachtet. Wie sinnvoll diese Erweiterung ist, sei dahingestellt.
Was die „gekreuzt-konjugierten“ Carbonylverbindungen betrifft, ergaben die HMO-Rechnungen, dass im großen Ganzen das Ausmaß der elektronischen Wechselwirkung mit der zweiten C=C-Doppelbindung bestenfalls gering ist.
Heute kennen wir die Grenzen von HMO-Betrachtungen, und es stellt sich die Frage, ob die Resultate dieser Theorie mit dem Experiment in Einklang stehen. Solange dies nicht klar ist, sollte der Begriff „Kreuzkonjugation“ mit großer Vorsicht verwendet werden. Er stammt aus einer Zeit vor der Entwicklung der quantenchemischen Theorien der Chemischen Bindung.
Einzelnachweise
- M. J. S. Dewar, Colour and constitution. Part III. Polyphenyls, polyenes, and phenylpolynes; and the significance of cross-conjugation, J. Chem. Soc., 1952, 3544–3550, doi:10.1039/JR9520003544.
- Hugo Kauffmann, Ueber den Zusammenhang zwischen Farbe und Konstitution bei chemischen Verbindungen, in: Sammlung chemischer und chemisch-technischer Vorträge (Hrsg. Felix B. Ahrens), Bd. 9, Stuttgart, Ferdinand Enke, 1904. Diese Arbeit gibt einen guten Überblick über die Anschauungen zu Beginn des 20. Jahrhunderts.
- J. Thiele, Berichte der Deutschen Chemischen Gesellschaft, 33, 666–673 (1900).
- H. Staudinger, Berichte der Deutschen Chemischen Gesellschaft, 41, 1493–1500 (1908), Berichte der Deutschen Chemischen Gesellschaft 42, 4249–4262 (1909).
- K. Auers, F. Eisenlohr, J. prakt. Chem. 84, 37–121 (1911).
- Nelson F. Phelan und Milton Orchin, Cross Conjugation, J. Chem. Educ. 45, 633–637 (1968).
- Berichte der Deutschen Chemischen Gesellschaft, 41, 1493–1500 (1908).