Lossen-Abbau
Die Lossen-Reaktion (auch Lossen-Abbau bzw. Lossen-Umlagerung) ist eine chemische Reaktion.[1] Hydroxamsäure-Derivate (in der Regel O-acylierte) werden am Stickstoff deprotoniert und lagern unter Abspaltung des Acyl-Restes in ein Isocyanat um. Sie ist eng verwandt mit dem Curtius-Abbau, dem Hofmann-Abbau bzw. der Schmidt-Reaktion. Sie wird vor allem verwendet, um Carbonsäurechloride zu primären Aminen abzubauen, es können jedoch auch je nach Reaktionsbedingungen Isocyanate oder Carbamate erhalten werden.
Die Reaktion wurde benannt nach ihrem Entdecker, dem deutschen Chemiker Wilhelm Lossen (1838–1906).

Reaktionsmechanismus
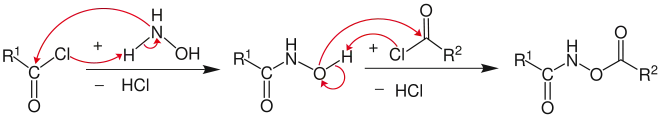
Hydroxamsäure-Derivate (=Carbonsäurehydroxylamide) entstehen durch Reaktion von Carbonsäurechloriden mit Hydroxylamin.
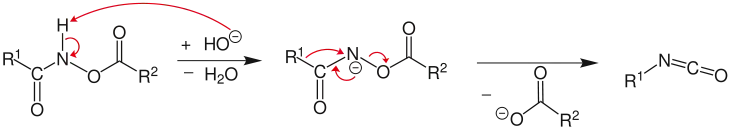
Das Hydroxamsäure-Derivat reagiert in Gegenwart einer Base (hier: ein Hydroxidion) und unter Bildung von Wasser zum entsprechenden Salz. Im nächsten Schritt entsteht unter Abspaltung des Carboxylat-Restes ein Isocyanat.[2]
Die Reaktion wird als konzertiert, teilweise aber auch mit kurzlebigen Zwischenprodukten beschrieben (Nitrene, Elektronenmangelverbindungen mit einem Elektronensextett am Stickstoff). Bei Durchführung in einem inerten Lösungsmittel bleiben die Isocyanate Endprodukt der Reaktion.
In Gegenwart von Wasser reagieren die entstandenen Isocyanate zur entsprechenden Carbaminsäure weiter, die unmittelbar decarboxyliert und als Endprodukt das primäre Amin ergibt. In Gegenwart von Alkoholen entstehen stabile Carbaminsäureester (Carbamate) und von Aminen substituierte Harnstoffe.
Unsubstituierte Hydroxam-Säuren reagieren nicht, die Hydroxygruppe ist eine zu schlechte Abgangsgruppe.[3][4] Der Substituent R kann als π- oder σ-Donor die Reaktion ebenfalls erleichtern. In Hydroxam-Säuren mit chiralen Resten R* bleibt deren Konfiguration meist erhalten.
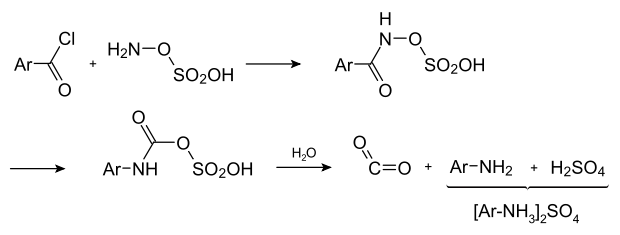
Eine interessante Variante ist die Umsetzung von Carbonsäurechloriden mit Hydroxylamin-O-sulfonsäure:[5] Hierbei zerfällt das Reaktionsprodukt beim Erhitzen zum Amin, Kohlendioxid und Schwefelsäure.[6]
Literatur
- T. Shiori: In: Comp. Org. Syn. 6, 1991, S. 821–825 (Übersichtsartikel).
- Hauser, C. R.; Renfrow, Jr., W. B.: Benzhydroxamic Acid In: Organic Syntheses. 19, 1939, S. 15, doi:10.15227/orgsyn.019.0015; Coll. Vol. 2, 1943, S. 67 (PDF).
- Thomas Laue, Andreas Plagens: Namen- und Schlagwort-Reaktionen der Organischen Chemie. Vieweg+Teubner, Wiesbaden 2009, ISBN 978-3-8351-0091-6, S. 218 (eingeschränkte Vorschau in der Google-Buchsuche).
Einzelnachweise
- W. Lossen: Ueber Benzoylderivate des Hydroxylamins. In: Justus Liebigs Annalen der Chemie. Band 161, Nr. 2-3, 1872, S. 347–362, doi:10.1002/jlac.18721610219.
- László Kürti, Barbara Czakó: Strategic Applications of Named Reactions in Organic Synthesis: Background and Detailed Mechanisms. Elsevier Academic Press, 2005, ISBN 978-0-12-429785-2, S. 266–267.
- Ludwig Bauer, Otto Exner: The Chemistry of Hydroxamic Acids and N-Hydroxyimides. In: Angewandte Chemie International Edition in English. Band 13, Nr. 6, 1. Juni 1974, S. 376–384, doi:10.1002/anie.197403761 (Übersichtsartikel).
- Harry L. Yale: The Hydroxamic Acids. In: Chemical Reviews. Band 33, Nr. 3, 1. Dezember 1943, S. 209–256, doi:10.1021/cr60106a002 (Übersichtsartikel).
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 81.–90. Auflage. Walter de Gruyter, Berlin 1976, ISBN 3-11-005962-2, S. 420.
- W. Lossen: Ueber die Structurformel des Hydroxylamins und seiner amidartigen Derivate. In: Justus Liebigs Annalen der Chemie. Band 175, Nr. 3, 1875, S. 271–304, doi:10.1002/jlac.18751750303.