Chlorphacinon
Chlorphacinon ist eine chemische Verbindung aus der Gruppe der Indanderivate (genauer vom 1,3-Indandion) und organischen Chlorverbindungen.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
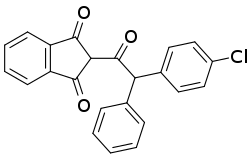 | |||||||||||||||||||
| Racemat | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Chlorphacinon | ||||||||||||||||||
| Andere Namen |
(RS)-2-(α-(4-Chlorphenyl)phenylacetyl)indan-1,3-dion | ||||||||||||||||||
| Summenformel | C23H15ClO3 | ||||||||||||||||||
| Kurzbeschreibung |
hellgelbe geruchlose Kristallnadeln[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 374,82 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
ca. 0,6 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
240 °C bei 0,8 mbar[1] | ||||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser (3,4 mg·l−1 bei 25 °C)[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Gewinnung und Darstellung
Chlorphacinon wird auf verschiedenen Synthesewegen hergestellt. Ein häufig gebrauchtes Verfahren geht von Phenylaceton aus, das mit Brom in Chlorbenzol zu 1-Brom-1-phenylaceton umgesetzt wird. Dieses reagiert dann mit Chlorbenzol in Gegenwart von Aluminiumtrichlorid unter wasserfreien Bedingungen zu 1-(4-Chlorphenyl)-1-phenylaceton, welches dann mit Phthalsäuredimethylester in Gegenwart von Natriummethanolat schließlich die Zielverbindung Chlorphacinon liefert.[3]
Eigenschaften
Chlorphacinon ist ein brennbarer hellgelber Feststoff, welcher praktisch unlöslich in Wasser ist. Er zersetzt sich bei Temperaturen über 320 °C.[1] Im Freien erfolgt schnelle Photolyse. Im Boden erfolgt der Abbau hauptsächlich durch Ringöffnung zu 4-Chlordiphenylessigsäure.[4]
Verwendung
Chlorphacinon wird als Rodentizid gegen Feld-, Erd- und Rötelmäuse verwendet.[1] Es wirkt durch Hemmung der Blutgerinnung durch Blockierung der Prothrombinbildung.[4]
Zulassung
In Deutschland wurde die Zulassung vom Bundesamt für Verbraucherschutz und Lebensmittelsicherheit zum 30. Juni 2010 widerrufen.[5] In den EU-Staaten wie Deutschland und Österreich sowie in der Schweiz sind keine Pflanzenschutzmittel zugelassen, die Chlorphacinon als Wirkstoff enthalten.[6]
Einzelnachweise
- Eintrag zu Chlorophacinon in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Januar 2017. (JavaScript erforderlich)
- Eintrag zu Chlorophacinone im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Patent DE102005055528: Verfahren zur Herstellung von 2-[(4-Chlorphenyl)-phenylacetyl]-1,3-indandion (Chlorphacinon). Angemeldet am 22. November 2005, veröffentlicht am 10. April 2008, Anmelder: CPI ChemiePark Institut, Bitterfeld, Erfinder: Alexander Barthel, René Csuk.
- M. Bahadir, H. Parlar, Michael Spiteller: Springer Umweltlexikon. 2000, ISBN 978-3-540-63561-1 (Seite 266 in der Google-Buchsuche).
- BVL - Fachmeldungen - Zulassungen von Pflanzenschutzmitteln mit den Wirkstoffen Brodifacoum, Chlorphacinon und Lecithin widerrufen. Abgerufen am 3. Juni 2019.
- Generaldirektion Gesundheit und Lebensmittelsicherheit der Europäischen Kommission: Eintrag zu Chlorophacinone in der EU-Pestiziddatenbank; Eintrag in den nationalen Pflanzenschutzmittelverzeichnissen der Schweiz, Österreichs und Deutschlands, abgerufen am 3. März 2016.


