Cerivastatin
Cerivastatin ist ein Arzneistoff aus der Gruppe der Statine, der zur Senkung erhöhter Blutfettwerte eingesetzt wurde. Cerivastatin stammt aus japanischer Entwicklung und wurde in Deutschland von den Unternehmen Bayer (Handelsname: Lipobay) und Fournier (Handelsname: Zenas) vertrieben. In den USA hat das Unternehmen Bayer Cerivastatin als Baycol vertrieben.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Freiname | Cerivastatin | |||||||||||||||
| Andere Namen |
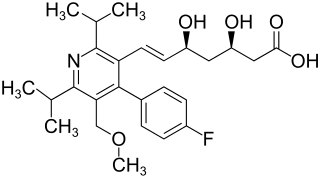
(3R,5S,6E)-7-[4-(4-Fluorphenyl)-5-(methoxymethyl)-2,6-bis(1-methylethyl)-3-pyridinyl]-3,5-dihydroxy-hept-6-ensäure (IUPAC) | |||||||||||||||
| Summenformel | C26H34FNO5 | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||
| ATC-Code |
C10AA06 | |||||||||||||||
| Wirkstoffklasse | ||||||||||||||||
| Wirkmechanismus | ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 459,55 g·mol−1 | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Das Medikament wurde im August 2001 von Bayer weltweit vom Markt genommen, nachdem nach seiner Einnahme zahlreiche Todesfälle bekannt geworden waren. Der Wirkstoff Cerivastatin, eine Substanz aus der pharmakotherapeutischen Klasse der Cholesterin-Synthese-Enzym(CSE)-Hemmer (auch Statin oder HMG-CoA-Reduktase-Hemmer genannt), hatte in Kombination mit Gemfibrozil (z. B. in Gevilon), einem ebenfalls lipidsenkenden Präparat, zu einer Zerstörung von Muskelgewebe (Rhabdomyolyse) und dadurch bedingtes Nierenversagen geführt. Als Ursache wird neben dem gemeinsamen Abbaumechanismus (CYP 2C8) von Cerivastatin und Fibraten eine Hemmung des Aufnahmetransporters OATP2 angenommen.[2][3]
Chronik
- 1997: Arzneimittelzulassung in Deutschland und anderen europäischen Ländern unter der Federführung der britischen Behörde
- Juli 1997: Zulassung in den USA
- November 1998: dem Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) wird der erste Todesfall in Deutschland gemeldet.
- Januar 2000: in den USA wird der erste Todesfall bekannt.
- März 2001: weitere Meldungen über Todesfälle gehen beim BfArM ein.
- Juni 2001: das BfArM fordert Bayer auf, den Beipackzettel zu ändern. Bayer ändert ihn dahingehend, dass die gleichzeitige Einnahme von Lipobay und Gemfibrozil kontraindiziert ist und weist die Ärzte in einem Rote-Hand-Brief darauf hin.
- 8. August 2001: Bayer nimmt Lipobay/Baycol in Europa und den USA vom Markt. Die Ad-hoc-Aktion ruft in Fachkreisen großen Unmut hervor, da Presse und Aktionäre aus aktienrechtlichen Gründen wenige Stunden vor Ärzten und Apothekern informiert worden waren, die den verunsicherten Patienten zunächst ratlos gegenüberstehen.
- 14. August 2001: in den USA werden die ersten Klagen gegen Bayer eingereicht, darunter von Ed Fagan für Bewohner New Jerseys.
- 23. August 2001: Bayer nimmt Lipobay/Baycol auch in Japan vom Markt
- 4. September 2001: die Staatsanwaltschaft Köln leitet ein Ermittlungsverfahren gegen Mitarbeiter von Bayer ein.
- 13. September 2001: das BfArM nimmt den Vorwurf zurück, Bayer habe Informationen über die Sicherheit von Lipobay zurückgehalten.
- Oktober 2005: Bayer zahlt 1,143 Mrd. USD und erzielt so einen Vergleich mit 3.058 Baycol-Geschädigten, das sind im Schnitt 373.733 USD pro Schadensklage.[4]
- 22. August 2012: Bayer wird in Argentinien zu einer Zahlung von 968.000 Pesos (rund 160.000 Euro) an einen Lipobay-Geschädigten verurteilt. Der Kläger, Flavio Rein, hatte nach einmonatiger Einnahme des Cholesterin-Senkers irreversible Muskelschädigungen (Rhabdomyolyse), Sehstörungen und Nierenschäden erlitten.[5]
- Januar 2013: Bayer wird von einem Gericht in Venedig zu einer Entschädigung von 350.000 Euro an ein Lipobay-Opfer verurteilt. Ein damals 51-jähriger Arzt hatte sich das Präparat im Jahr 1999 selbst verschrieben. Zwei Monate später erlitt er eine lebensbedrohliche Rhabdomyolyse (Muskelzerfall) und war zu 100 % arbeitsunfähig geworden. Er bezieht seitdem eine Invalidenrente. BAYER muss auch die Verfahrenskosten in Höhe von 14.000 Euro tragen.[6]
Weblinks
Einzelnachweise
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Furberg CD, Pitt B: Withdrawal of cerivastatin from the world market. In: Curr Control Trials Cardiovasc Med. 2, Nr. 5, 2001, S. 205–207. PMID 11806796. PMC 59524 (freier Volltext).
- Shitara Y, Hirano M, Sato H, Sugiyama Y.: Gemfibrozil and its glucuronide inhibit the organic anion transporting polypeptide 2 (OATP2/OATP1B1:SLC21A6)-mediated hepatic uptake and CYP2C8-mediated metabolism of cerivastatin: analysis of the mechanism of the clinically relevant drug-drug interaction between cerivastatin and gemfibrozil.. In: J Pharmacol Exp Ther. 311, 2004. PMID 15194707.
- Argentinien: BAYER zu Entschädigung verurteilt, abgerufen am 11. April 2019.
- Argentinien: BAYER zu Entschädigung verurteilt, abgerufen am 11. April 2019.
- BAYER in Italien zu Entschädigung verurteilt, abgerufen am 1. Februar 2022.