Carbylsulfat
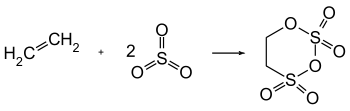
Carbylsulfat (1,3,2,4-Dioxadithian-2,2,4,4-tetroxid) ist eine Additionsverbindung aus Ethylen und Schwefeltrioxid, über die erstmals in den Jahren 1838 Regnault[5] und 1839 Heinrich Gustav Magnus[6][7] als Produkt der Umsetzung von wasserfreiem Ethanol und wasserfreier Schwefelsäure berichteten.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
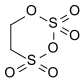 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Carbylsulfat | |||||||||||||||
| Andere Namen |
1,3,2,4-Dioxadithian-2,2,4,4-tetraoxid | |||||||||||||||
| Summenformel | C2H4O6S2 | |||||||||||||||
| Kurzbeschreibung |
farbloser, kristalliner Feststoff, der an feuchter Luft zerfließt[1][2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 188,18 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
1,85 g·cm−3[3] | |||||||||||||||
| Schmelzpunkt |
102–108 °C[1] | |||||||||||||||
| Siedepunkt |
327,5 °C bei 1013 hPa[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Carbylsulfat entsteht bei der stark exothermen (Reaktionsenthalpie ca. 3.350 kJ/kg) Reaktion von Ethylen und Schwefeltrioxid in der Dampfphase in fast quantitativer Ausbeute.[8][1]
Der industrielle Herstellungsprozess wird in einem bzw. zwei hintereinander geschalteten Rohrbündelreaktoren mit trockenem Ethylen und gasförmigem Schwefeltrioxid im Mischungsverhältnis von 1:2,2 bis 1:2,4 bei 115 °C bis 140 °C durchgeführt und flüssiges Carbylsulfat am Reaktorboden kontinuierlich abgezogen. Der Reaktionsumsatz liegt bereits im ersten Reaktor bei mindestens 80 %.[1] Als Sulfonierungsmittel können auch Dischwefelsäure bzw. Oleum oder Chlorsulfonsäure eingesetzt werden, statt Ethylen auch Verbindungen, die mit dem Sulfonierungsmittel Ethylen bilden, z. B. Ethanol oder Diethylether.[8]
Eigenschaften
Carbylsulfat ist eine farblose, kristalline, hygroskopische Substanz mit stechendem Geruch nach Schwefeldioxid und hoher Reaktivität, die beim Erhitzen über 170 °C zur explosionsartigen Zersetzung führen kann. Das im industriellen Prozess als wasserklare Schmelze anfallende Carbylsulfat weist – in Übereinstimmung mit D.S. Breslow[8] (107,5–109 °C) – einen Schmelzbereich von 102 bis 108 °C auf. Der bereits 1839[7] angegebene Schmelzpunkt von ca. 80 °C ist auf anhaftendes Schwefeltrioxid zurückzuführen.[8] Wegen seiner unangenehmen Eigenschaften ist Carbylsulfat schwer handhabbar und wird in der Regel nicht isoliert, sondern direkt zu Folgeprodukten weiterverarbeitet.
Verwendung
Carbylsulfat dient als Ausgangsmaterial für Vinylsulfonsäure bzw. Natriumvinylsulfonat (englisch sodium vinylsulfonate, SVS), die wichtige aktivierte Alkene darstellen und u. a. als anionische Comonomere eingesetzt werden. Durch nucleophile Addition an die aktivierte Doppelbindung der Vinylsulfonsäure und ihrer Derivate sind eine Reihe funktioneller Verbindungen mit vielfältigen Anwendungen zugänglich.[9]
Abgeleitete Verbindungen
- Vinylsulfonsäure
- Natriumvinylsulfonat
- Isethionsäure
- Natriumisethionat
Einzelnachweise
- Patentanmeldung DE2509738A1: Verfahren zur Herstellung von Carbylsulfat. Angemeldet am 6. März 1975, veröffentlicht am 23. September 1976, Anmelder: BASF, Erfinder: Rudolf Irnich, Rolf Schneider.
- Adolph Strecker: Kurzes Lehrbuch der Organischen Chemie. 4. verbesserte Auflage, Druck und Verlag von Friedrich Vieweg und Sohn, Braunschweig 1863, S. 336.
- Eintrag 1,3,2,4-Dioxadithiane,2,2,4,4-tetraoxide bei Guidechem, abgerufen am 21. Juni 2013.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Regnault, Ann., 25, 32 (1838).
- Magnus, Ann., 31, 249 (1839) und G. Magnus, "Ueber das Carbylsulfat und die Aethionsäure", Pogg. Ann. ( = Annalen der Physik), XLVII, 609 (1839).
- "Zur Erinnerung an Gustav Magnus". Nach einem am 14. December 1870 in der General-Versammlung der Deutschen Chemischen Gesellschaft zu Berlin gehaltenen Vortrage August Wilhelm Hofmann s, Berlin, Ferd. Dümmler's Verlagsbuchhandlung, 1871 (S. 32).
- David S. Breslow, Robert R. Hough: The Synthesis of Sodium Ethylenesulfonate from Ethylene. In: Journal of the American Chemical Society. Band 79, Nr. 18, September 1957, S. 5000–5002, doi:10.1021/ja01575a046.
- H. Distler: Zur Chemie der Vinylsulfonsäure. In: Angewandte Chemie. Band 77, Nr. 7, 7. April 1965, S. 291–302, doi:10.1002/ange.19650770704.