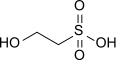
Isethionsäure
Isethionsäure (2-Hydroxyethansulfonsäure) ist die einfachste hydroxygruppenhaltige Alkansulfonsäure. Sie eignet sich wegen ihrer hohen Polarität und der relativ guten Löslichkeit ihrer Erdalkalimetallsalze zur Veresterung mit langkettigen Carbonsäuren zu Isethionaten (Acyloxyethansulfonaten), die als anionische Tenside eingesetzt werden.[4]
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Isethionsäure | ||||||||||||||||||
| Andere Namen |
2-Hydroxyethansulfonsäure | ||||||||||||||||||
| Summenformel | C2H6O4S | ||||||||||||||||||
| Kurzbeschreibung |
klare, hochviskose Flüssigkeit[1], die beim Abkühlen erstarrt[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 126,13 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Gewinnung und Darstellung
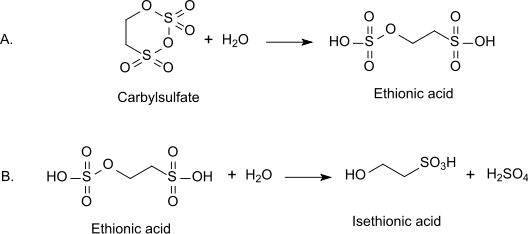
Isethionsäure kann durch Hydrolyse von Carbylsulfat über Ethionsäure als instabiles Zwischenprodukt erhalten werden.[5]
Die entstehende Schwefelsäure erschwert die Isolierung der Isethionsäure, in nach Aufkonzentrierung der verdünnten Lösung zudem als Monohydrat vorliegt.[2] Die als Zwischenprodukt anfallende Ethionsäure entsteht auch durch Reaktion von einem Mol Ethanol mit zwei Mol Schwefeltrioxid[6] und geht beim Erhitzen mit Natronlauge unter Wasserabspaltung in Natriumvinylsulfonat über.
Die Oxidation von 2-Mercaptoethanol mit Wasserstoffperoxid (60 Gew.-%) liefert nach Abtrennung der als Nebenprodukt entstehenden Schwefelsäure bis 99,9 % reine Isethionsäure in hoher Ausbeute (95,9 % d.Th.) als 50 gewichtsprozentige wässrige Lösung.[7]
Wegen der einfacheren Zugänglichkeit des Natriumisethionats – aus den preisgünstigen Rohstoffen Ethylenoxid und Natriumhydrogensulfit – dient dieses als gängiges Ausgangsmaterial für die Darstellung der Isethionsäure durch Ansäuern mit Mineralsäure, wie z. B. konz. Salzsäure mit 80%iger Ausbeute,[8] mit organischen Säuren, wie z. B. Oxalsäure mit 94%iger Ausbeute[1] oder durch Einleiten von trockenem HCl-Gas in alkoholische Natriumisethionat-Lösungen mit quantitativer Ausbeute.[2]
Eigenschaften
Isethionsäure wird meist als farblose, viskose Flüssigkeit beschrieben, die mit Wasser mischbar ist und in wässriger Lösung stark sauer reagiert. Die Darstellung der Isethionsäure nach Lit.[2] führt zu einem wasser- und chloridfreien Produkt, das beim Abkühlen zu einem Feststoff kristallisiert.
Verwendung
Isethionsäure wird in Galvanikbädern, z. B. zur Verzinnung von Metallen[9] eingesetzt und findet Verwendung zur Herstellung von Tinten und Harzen, sowie als saurer Katalysator.[2] Bereits 1862 identifizierte Hermann Kolbe das Umsetzungsprodukt von Isethionsäure mit Ammoniak[10] als 2-Aminoethansulfonsäure (Taurin) und widerlegte die Vermutung, es handele sich um Isethionsäureamid. Aus Isethionsäure können die von N.E. Good vorgeschlagenen biologischen Puffer[11] durch Umsetzung mit entsprechenden funktionellen Aminen dargestellt werden, wie z. B. HEPES, MES, CHES und andere.[12] Isethionsäure dient ebenfalls als Ausgangsmaterial für Tenside aus der Klasse der (Acyl-)Isethionate, allerdings wird hierzu das einfacher zugängliche Natriumisethionat bevorzugt.
Einzelnachweise
- Patent US5053530: Preparation of isethionic acid with organic acid. Angemeldet am 10. April 1990, veröffentlicht am 1. Oktober 1991, Anmelder: Phillips Petroleum Corp., Erfinder: J.S. Roberts, H.W. Mark.
- Patent US4696773: Process for the preparation of isethionic acid. Angemeldet am 7. Juli 1986, veröffentlicht am 29. September 1987, Anmelder: Johnson & Johnson Baby Products Co., Erfinder: E.R. Lukenbach, P. Naik-Satam, A.M. Schwartz.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Kurt Kosswig: Sulfonic Acids, Aliphatic. In: Wiley-VCH (Hrsg.): Ullmann's Encyclopedia of Industrial Chemistry. 2000. doi:10.1002/14356007.a25_503.
- D.L. Wooton, W.G. Lloyd: Hydrolytic reactions of carbyl sulfate. In: J. Org. Chem. Band 39, Nr. 14, 1974, S. 2112–2114, doi:10.1021/jo00928a031.
- D.S. Breslow, R.R. Hough, J.T. Fairclough: Synthesis of sodium ethylenesulfonate from ethanol. In: J. Am. Chem. Soc. Band 76, Nr. 21, 1954, S. 5361–5363, doi:10.1021/ja01650a033.
- Patent EP0854136A1: Process for the production of alkanesulfonic acids. Angemeldet am 20. Januar 1998, veröffentlicht am 22. Juli 1998, Anmelder: Tokai Denka Kogyo K.K., Erfinder: K. Kushibe, H. Kobayashi, H. Nitoh, H. Kitamura.
- Patent US4499028: Preparation of isethionic acid. Angemeldet am 7. September 1982, veröffentlicht am 12. Februar 1985, Anmelder: Witco Chemical Corp., Erfinder: K.D. Longley.
- Patent WO2008100648A1: High speed tin plating process. Angemeldet am 4. Januar 2008, veröffentlicht am 21. August 2008, Anmelder: Arkema Inc., Erfinder: N.M. Martyak, G.E. Stringer, G.S. Smith.
- H. Kolbe: XIX.-On the chemical constitution and artificial formation of taurine. In: J. Chem. Soc. Band 15, 1862, S. 94–104, doi:10.1039/JS8621500094.
- N.E. Good, G.D. Winget, W. Winter, T.N. Connolly, S. Izawa, R.M.M. Singh: Hydrogen ion buffers for biological research. In: Biochemistry. Band 5, Nr. 2, 1966, S. 467–477, doi:10.1021/bi00866a011.
- Datenblatt "Good" buffers bei Sigma-Aldrich, abgerufen am 17. Juni 2013 (PDF).