Blauflecken-Querzahnmolch
Der Blauflecken-Querzahnmolch[1] (Ambystoma laterale), auch Blaufleck-Querzahnmolch[2] oder Blaupunktsalamander[3] genannt, ist ein im östlichen Nordamerika verbreiteter Schwanzlurch aus der Familie der Querzahnmolche (Ambystomatidae). Im Osten Nordamerikas ist es die am nördlichsten vorkommende Art aus der Familie[4] und kann noch in Gebieten von bis zu 55° nördlicher Breite vorkommen.[5]
| Blauflecken-Querzahnmolch | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Blauflecken-Querzahnmolch (Ambystoma laterale) | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Ambystoma laterale | ||||||||||||
| Hallowell, 1856 |
Forschungsgeschichte
Die Art wurde 1856 durch Edward Hallowell bereits unter der noch heute gebräuchlichen Bezeichnung Ambystoma laterale erstmals wissenschaftlich beschrieben.[6] 1868 interpretierte Edward Drinker Cope Ambystoma laterale als Varietät des Jefferson-Querzahnmolches (Ambystoma jeffersonianum). Gleichzeitig beschrieb er mit Ambystoma platineum eine neu Art innerhalb der Gattung und betonte insbesondere deren Ähnlichkeit mit Ambystoma jeffersonianum var. laterale.[7] Mehrere Jahre später revidierte Cope seine ursprüngliche Meinung teilweise und wertete die von ihm neu beschriebene Art nun ebenfalls als Unterart des Jefferson-Querzahnmolches.[8] Copes Gliederung (nur eine Art mit drei Unterarten) hatte für mehrere Jahrzehnte Gültigkeit.
1934 beschrieb Wesley Clanton eine Population dieser Schwanzlurche aus dem Süden von Michigan, in der er zwei unterschiedliche Formen unterscheiden konnte, die er schlicht als „dunkle Form“ und als „helle Form“ bezeichnete. Beide Formen paarten sich offenbar untereinander. Zu Clantons Überraschung zeigte die von ihm untersuchte Gesamtpopulation einige Besonderheiten in Bezug auf die Geschlechterverteilung. Weibliche Tiere waren wesentlich häufiger als männliche, wobei das Verhältnis zwischen Weibchen und Männchen zwischen 2 : 1 und 52 : 1 variieren konnte. Der Überschuss an Weibchen war offenbar auf die „helle Form“ zurückzuführen; wurde nur die „dunkle Form“ betrachtet, fand er stets ein Verhältnis von annähernd 1 : 1. Zudem stellte Clanton fest, dass die „helle Form“ zu fast 100 % aus weiblichen Tieren bestand. Kreuzungsversuche zeigten ihm, dass bei einer Paarung zwischen Männchen und Weibchen der „dunklen Form“ stets etwa gleich viele weibliche und männliche Larven der „dunklen Form“ aus den Eiern schlüpften, während eine Paarung von „hellen Weibchen“ und „dunklen Männchen“ ausschließlich weibliche Exemplare der „hellen Form“ hervorbrachte. Er vermutete zwar, dass es sich bei der „hellen Form“ um eine Hybride handelte und stellte Überlegungen zum weiteren Fortbestand der Gesamtpopulation an, zog aber keine Rückschlüsse auf die taxonomischen Konsequenzen seiner Beobachtungen.[9]
Mit Ambystoma tremblayi wurde 1943 aus dem Süden Kanadas eine weitere, sehr ähnliche Form als eigenständige Art beschrieben.[10] 1954 identifiziert Sherman A. Minton Clantons „dunkle Form“ als Ambystoma laterale und verleiht ihr ebenfalls wieder eigenständigen Artstatus. Clantons „helle Form“ identifizierte er als Hybride zwischen Ambystoma laterale und Ambystoma jeffersonianum.[11]
Erst in den 1960er Jahren gelang es Thomas M. Uzzell Jr. in mehreren Arbeiten den Knoten zu lösen. Ihm gelang der Nachweis, dass es sich bei den im Wesentlichen rein weiblichen Formen, die er zwei Arten (Ambystoma platineum und Ambystoma tremblayi) zuordnete um Tiere mit triploiden Chromosomensätzen (3n = 42) handelt, die durch Hybridisierung aus zwei Arten (Ambystoma laterale und Ambystoma jeffersonianum) mit normaler Geschlechterverteilung und diploiden Chromosomensätzen (2n = 28) entstanden waren. Gemeinsam mit Sarah M. Goldblatt fand er Hinweise, dass Ambystoma tremblayi über zwei Chromosomensätze von Ambystoma laterale und einen Chromosomensatz von Ambystoma jeffersonianum verfügt, während bei Ambystoma platineum die umgekehrten Verhältnisse vorliegen.[12]
.jpg.webp)
Merkmale
Erwachsene Tiere erreichen eine Gesamtlänge von 7 bis 14 Zentimetern, wobei etwa 40–50 % auf den langen Schwanz entfallen.[13] Die Männchen bleiben im Durchschnitt etwas kleiner als die Weibchen und haben einen etwas längeren Schwanz in Relation zum Rumpf. Der Rumpf selbst wird durch 12–14 Rippenfurchen segmentiert.[14]
Die Grundfärbung am Rücken ist schwarz bis grauschwarz, am Bauch etwas heller. Rücken, Bauch und vor allem die unteren Bereiche der Flanken zeigen eine Vielzahl an bläulich-weißen Flecken. Die auffällige Zeichnung der Flanken brachte dem Blauflecken-Querzahnmolch auch seinen wissenschaftlichen Artzusatz laterale (nach dem lateinischen lateralis – „seitlich“) ein.[15]
Die Weibchen der triploiden Hybridform Ambystoma tremblayi werden mit einer Gesamtlänge von bis zu 16 Zentimetern etwas größer als die Weibchen der diploiden Form. Die Grundfärbung ist etwas heller und wird als dunkelgrau bis grauschwarz beschrieben. Die bläuliche Farbzeichnung ist weniger stark ausgeprägt und diffus.[16]
Verbreitung, Lebensraum, Lebensweise
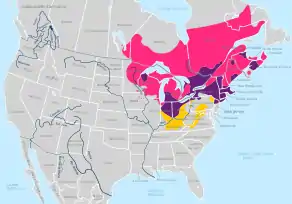
Der Blauflecken-Querzahnmolch kommt in nordöstlichen Staaten der Vereinigten Staaten rund um die Großen Seen (Minnesota, Michigan, Wisconsin, Indiana, Illinois, Ohio, New York), in Iowa und New Jersey und den Neuenglandstaaten New Hampshire, Connecticut, Maine, Massachusetts und Vermont vor. Im südöstlichen Kanada erstreckt sich das Verbreitungsgebiet über die Provinzen Ontario, Québec, die Seeprovinzen Prince Edward Island, Nova Scotia und New Brunswick sowie die Teilprovinz Labrador. Im Süden überlappt das Verbreitungsgebiet mit dem des Jefferson-Querzahnmolches. Hier dominieren die Hybriden der beiden Arten.[17]
Die Populationen befinden sich vorwiegend nördlich der sogenannten Wisconsin-Glaziallinie (Vergletscherungsgrenze der letzten Kaltzeit; die Wisconsin-Kaltzeit entspricht der Würm-Kaltzeit im europäischen Alpenraum und der Weichsel-Kaltzeit in Nord- und nördlichem Mitteleuropa). Es kann dementsprechend davon ausgegangen werden, dass der Blauflecken-Querzahnmolch sein heutiges Verbreitungsgebiet erst nach Ende der letzten Kaltzeit besiedelt hat.[18]
Als Landlebensräume werden feuchte Laub- und Mischwälder und sumpfiges Buschland bevorzugt. Tagsüber verbergen sich die Tiere in Nagetrierbauten, unter Totholz, Falllaub oder Felsen, um in der Abenddämmerung und nachts auf Nahrungssuche nach Insekten, Würmern und Schnecken zu gehen. Die Überwinterung findet in frostsicheren Unterschlüpfen an Land statt. Als Fortpflanzungsgewässer dienen zeitweise wasserführende Kleingewässer wie Tümpel und Gräben innerhalb von Wäldern, die nicht zu früh austrocknen dürfen, um die Larvenentwicklung zu gewährleisten.[19]
Fortpflanzung und Individualentwicklung

Die Paarungszeit beginnt im Frühjahr, unmittelbar nach Ende der Frostperiode. Ausgelöst durch die ersten Frühjahrsregenfälle wandern die Blauflecken-Querzahnmolche zu ihren Laichgewässern.[20][21] Innerhalb weniger Tage findet dann das Laichgeschehen statt („Explosivlaichen“; vergleiche beispielsweise Grasfrosch). Die Paarung erfolgt unter Wasser und beginnt mit dem gegenseitigen Erkennen eines Partners. Dies erfolgt einerseits durch Abgabe chemischer Lockstoffe und andererseits durch Anstupsen im Bereich der Flanken und der Kloakenregion. Wurde eine paarungsbereite Partnerin erkannt, umklammert das Männchen das Weibchen vom Rücken her mit den Vorderbeinen im Bereich des Schultergürtels (dorsaler Amplexus). In weiterer Folge entlässt das Männchen das Weibchen wieder aus der Umklammerung, bewegt sich weiter nach vorne und deponiert eine oder mehrere Spermatophoren am Substrat, die vom Weibchen aufgenommen werden.[22][23]
Die Eiablage erfolgt innerhalb von zwei Tagen nach der Paarung.[24] Ein Weibchen produziert 120 bis 300 (im Durchschnitt 216) gallertumhüllte Eier je Saison.[9] Die Eier werden meist einzeln oder in kleinen Klumpen von zwei bis vier Stück an Wasserpflanzen oder Pflanzenresten im Wasser abgelegt.[15]
Nach drei bis vier Wochen schlüpfen die Larven und beginnen nun eine aquatile Lebensweise.[19] Dabei ernähren sie sich vor allem von Kleinkrebsen (Daphnien, Ostrakoden) und Mückenlarven.[20] Zwei bis drei Monate nach dem Schlupf erfolgt die Metamorphose; das weitere Leben findet an Land statt.[25] Nach zwei Jahren werden die Tiere schließlich geschlechtsreif.[24] Männchen weisen zu diesem Zeitpunkt eine Kopf-Rumpf-Länge von mindestens 42 mm auf. Geschlechtsreife Weibchen sind mit einer Kopf-Rumpf-Länge von mindestens 51 mm etwas größer.[15]
Hybridisierung, Gynogenese und Kleptogenese


Im Laufe der Zeit wurden neben Ambystoma platineum und Ambystoma tremblayi noch weitere Hybridformen des Blauflecken-Querzahnmolches identifiziert; nicht nur mit dem Jefferson-Querzahnmolch (Ambystoma jeffersonianum), sondern auch mit anderen Vertretern der Gattung wie dem Schmalkopf-Querzahnmolch (Ambystoma texanum) und dem Östlichen Tigersalamander (Ambystoma tigrinum). Die Artengruppe und ihre Hybriden wird auch als „Ambystoma-Komplex“ bezeichnet. Hybriden des „Ambystoma-Komplexes“ können jeweils einen unterschiedlichen Ploidiegrad aufweisen. Neben diploiden und triploiden Formen können auch tetraploide und sogar pentaploide Formen auftreten. Alle diese Hybriden bilden fast ausschließlich nur Weibchen aus und alle weisen zumindest einen Chromosomensatz von Ambystoma laterale auf.[26]
Um der wachsenden Anzahl unterschiedlichster Hybriden Herr zu werden wurde eine einfache Kodierung eingeführt, welche die einzelnen Chromosomensätze der Elterntaxa symbolisiert. Dabei entsprechen
- „J“ für Ambystoma jeffersonianum – (JJ)
- „L“ für Ambystoma laterale – (LL)
- „T“ für Ambystoma texanum – (TT) und
- „Ti“ für Ambystoma tigrinum – (TiTi)
den Chromosomensätzen der beteiligten diploiden, zweigeschlechtlichen Arten.[27] Die von Uzzell definierten triploiden Hybriden haben dementsprechend die Kodierungen LLJ für Ambystoma tremblayi und LJJ für Ambystoma platineum.[28] Lokal können bis zu 70 Prozent einer Population aus solchen Hybriden bestehen.[29]
Die rein weibliche Populationen, die klonal-triploide Chromosomensätze aufweisen, benutzen das Sperma von Männchen verschiedener Ambystoma-Arten zur Stimulation der Eiablage, ohne jedoch ihre Erbinformationen (Chromosomen) zu benötigen und weiterzutragen. Dieses bei Querzahnmolchen in den 1960er-Jahren entdeckte Phänomen wird auch als Gynogenese bezeichnet.[20]
Untersuchungen der mitochondrialen DNA (mtDNA) der weiblichen Hybridpopulationen zeigen jedoch kaum Ähnlichkeiten mit der mtDNA der potentiellen Elterntaxa. Stattdessen zeigt sich hier eine enge Verwandtschaft mit einer Population von Ambystoma barbouri („BB“) aus Kentucky, abseits des Verbreitungsgebietes von Ambystoma laterale und der damit verknüpften Hybriden. Die Unterschiede in der mtDNA weisen darauf hin, dass sich die rein weiblichen Hybriden vor etwa 2,4–3,9 Ma von dieser Ambystoma barbouri-Population abgespalten haben. In der chromosomalen DNA der Hybridformen finden sich hingegen keine Spuren von Ambystoma barbouri mehr. Das deutet darauf hin, dass die Hybriden regelmäßig chromosomale DNA der „Samenspender“ in ihre eigene DNA einbauen und sich somit im Laufe der Zeit genetisch immer mehr an diese angleichen. Für diese ungewöhnliche Form der Fortpflanzung wurde der Begriff der Kleptogenese (nach dem altgriechischen κλέφτης - kleptěs = „Dieb“ und γένεσις - genesis = „Geburt“, „Entstehung“) vorgeschlagen. Da alle Hybriden über zumindest einen Chromosomensatz von Ambystoma laterale verfügen, scheint der Blauflecken-Querzahnmolch bei diesem Prozess eine entscheidende Schlüsselrolle gespielt zu haben.[30]
Gefährdung
Der Gesamtbestand dieser Art wird derzeit nicht als bedroht angesehen. In der Roten Liste der Weltnaturschutzunion wird der Blauflecken-Querzahnmolch daher als „nicht gefährdet“ („least concern“) geführt.[17] In einzelnen Staaten im Nordosten der USA wird der Status der Art dagegen als „besorgniserregend“ („special concern“), „bedroht“ („threatened“) oder „gefährdet“ („endangered“) eingestuft.[29] Gründe sind unter anderem der Verlust von naturnahen Wäldern und Waldgewässern, Kahlschlag in Forsten[17] sowie saurer Regen, der den pH-Wert in den Larvenhabitaten unter eine kritische Grenze (etwa pH 4,5 bis 5) herabsetzt.[31] Auch die Konkurrenz mit eingeschlechtlichen Populationen (siehe oben) könnte lokale „Normalbestände“ in ihrer Ausbreitung hemmen.
Literatur
- J. Alan Holman: The Amphibians and Reptiles of Michigan - A Quaternary and Recent Faunal Adventure, Ambystoma laterale, S. 31 ff., Wayne State University Press, 2012, ISBN 0814332390, (Online Version - Google books)
Einzelnachweise
- H. Zucchi & R. Gonschorek: Zur Biologie, insbesondere zur Verhaltensbiologie des Axolotls Ambystoma mexicanum (Shaw, 1789) (Caudata: Ambystomatidae). In: Salamandra, Band 19, Nummer 3, 1983, S. 123–140, (Digitalisat).
- Th. C. H. Cole: Wörterbuch der Tiernamen: Latein-Deutsch-Englisch Deutsch-Latein-Englisch. 2. Auflage, Springer Verlag, 2015, ISBN 978-3-662-44241-8, S. 18, (Leseprobe).
- F. Mutschmann: Erkrankungen der Amphibien. 2. Auflage, Enke Verlag, 2010, ISBN 978-3-8304-1097-3, S. 18, (Leseprobe).
- K. J. Ryan, J. D. Zydlewski & A. J. K. Calhoun: Using Passive Integrated Transponder (PIT) Systems for Terrestrial Detection of Blue-Spottet Salamanders (Ambystoma laterale) in situ. In: Herpetological Conservation and Biology, Band 9, Nummer 1, 2014, S. 97–105, (Digitalisat).
- W. E. Duellman & S. S. Sweet: Distribution Patterns of Amphibians in the Nearctic Region of North America. In: W. E. Duellman (Hrsg.): Patterns of Distribution of Amphibians: A Global Perspective. Johns Hopkins University Press, 1999, ISBN 0-8018-6115-2, S. 31–110, (Leseprobe)
- E. Hallowell: Description of several species of Urodela, with remarks on the geographical distribution of the Caducibranchiate Division of these animals and their classification. In: Proceedings of the Academy of Natural Sciences of Philadelphia, Band 8, 1856, S. 6–11, (Digitalisat).
- E. D. Cope: A review of the species of the Amblystomidae. In: Proceedings of the Academy of Natural Sciences of Philadelphia, Band 19, 1868, S. 166–211, (Digitalisat)
- E. D. Cope: Check-list of North American Batrachia and Reptilia; with a systematic list of the higher groups, and an essay on geographical distribution. Based on the specimens contained in the U.S. National Museum. In: Bulletin of the United States National Museum, Band 1, 1875, S. 1–104, (Digitalisat).
- W. Clanton: An unusual situation in the salamander Ambystoma jeffersonianum (Green). In: Occasional Papers of the Museum of Zoology - University of Michigan, Band 290, 1934, S. 1–14, (Digitalisat).
- N.-M. Comeau: Une ambystome nouvelle. In: Annales de l'Association Canadienne-Française pour l'Avancement des Sciences, Band 9, 1943, S. 124–125.
- Sh. A. Minton: Salamanders of the Ambystoma jeffersonianum complex in Indiana. In: Herpetologica, Band 10, Nummer 3, 1954, S. 174–179.
- Th. M. Uzzell Jr. & S. M. Goldblatt: Serum Proteins of Salamanders of the Ambystoma jeffersonianum Complex, and the Origin of the Triploid Species of this Group. In: Evolution, Band 21, Nummer 2, 1967, S. 345–354, (Digitalisat).
- W. F. Weller & W. G. Sprules: Taxonomic status of male salamanders of the Ambystoma jeffersonianum complex from an Ontario population, with the first record of the Jefferson salamander, A. jeffersonianum (Green), from Canada . In: Canadian Journal of Zoology, Band 54, 1976, S. 1270–1276, (Digitalisat).
- F. L. Downs: Unisexual Ambystoma from the Bass Islands of Lake Erie. In: Occasional Papers of the Museum of Zoology - University of Michigan, Nummer 685, 1978, 36 S., (Digitalisat).
- Th. M. Uzzell Jr.: Ambystoma laterale Hallowell - Blue-spotted Salamander. In: Catalogue of American Amphibians and Reptiles (CAAR), Eintrag 48, 1967, S. 48.1–48.2, (https://repositories.lib.utexas.edu/handle/2152/44974 [Digitalisat]).
- Th. M. Uzzell Jr.: Ambystoma tremblayi Comeau - Tremblay's salamander. In: Catalogue of American Amphibians and Reptiles (CAAR), Eintrag 50, 1967, S. 50.1–50.2, (https://repositories.lib.utexas.edu/handle/2152/44978 [Digitalisat]).
- Ambystoma laterale in der Roten Liste gefährdeter Arten der IUCN 2015.4. Eingestellt von: IUCN SSC Amphibian Specialist Group, 2015. Abgerufen am 6. März 2019.
- J. W. Demastes, J. M. Eastman & J. S. East: Phylogeography of the Blue-spotted Salamander, Ambystoma laterale (Caudata: Ambystomatidae). In: American Midland Naturalist, Band 157, 2009, S. 149–161, (Digitalisat)
- Massachusetts Division of Fisheries & Wildlife: Blue-spottet Salamander Fact Sheet. 2016, 6 S., (Digitalisat).
- H. M. Wilbur: The Ecological Relationship of the Salamander Ambystoma laterale to its All-Female, Gynogenetic Associate. In: Evolution, Band 25, Nummer 1, 1971, S. 168–179, (Digitalisat)
- L. A. Lowcock, H. Griffith & R. W. Murphy: The Ambystoma laterale-jeffersonianum Complex in Central Ontario: Ploidy Structure, Sex Ratio, and Breeding Dynamics in a Bisexual-unisexual Community. In: Copeia, Band 1991, Nummer 1, 1991, S. 87–105, (Digitalisat)
- M. G. Bolek: Ambystoma laterale (Blue-spotted Salamander) Courtship and egg laying behavior. In: Herpetological Review, Band 29, Nummer 3, 1998, S. 162, (Digitalisat)
- L. D. Houck & St. J. Arnold: Courtship and Mating Behavior. In: B. G. M. Jamieson (Hrsg.): Reproductive Biology and Phylogeny of Urodela, Science Publishers, Inc., 2003, ISBN 978-1-57808-271-1, S. 383–424, (Digitalisat).
- H. M. Wilbur: Propagule Size, Number, and Dispersion Pattern in Ambystoma and Asclepias. In: The American Naturalist, Band 111, Nummer 977, 1977, S. 43–68, (Digitalisat).
- L. E. Licht & J. P. Bogart: Growth and sexual maturation in diploid and polyploid salamanders (genus Ambystoma). In: Canadian Journal of Zoology, Band 67, 1989, S. 812–818, (Digitalisat).
- S. Noël, J. Dumoulin, M. Ouellet, P. Galois & F.-J. Lapointe: Rapid Identification of Salamanders from the Jefferson Complex with Taxon-Specific Primers. In: Copeia, Nummer 1, 2008, S. 158–161, (Digitalisat).
- K. Bi, J. P. Bogart & J. Fu: The prevalence of genome replacement in unisexual salamanders of the genus Ambystoma (Amphibia, Caudata) revealed by nuclear gene genealogy. In: BMC Evolutionary Biology, Band 8, Nummer 158, 2008, 9 S. doi:10.1186/1471-2148-8-158.
- J. P. Bogart & L. E. Licht: Reproduction and the origin of polyploids in hybrid salamanders of the genus Ambystoma. In: Canadian Journal of Genetics and Cytology, Band 28, Nummer 4, 1986, S. 605–617, (Digitalisat).
- J. P. Bogart & M. W. Klemens: Additional Distributional Records of Ambystoma laterale, A. jeffersonianum (Amphibia: Caudata) and Their Unisexual Kleptogens in Northeastern North America. In: American Museum Novitates, Nummer 3627, 2008, 58 S., (Digitalisat)
- J. P. Bogart, K. Bi, J. Fu, D. W. A. Noble & J. Niedzwiecki: Unisexual salamanders (genus Ambystoma) present a new reproductive mode for eukaryotes. In: Genome, Band 50, 2007, S. 119–136, (Digitalisat).
- F. J. Kutka & M. D. Bachmann: Acid sensitivity and water chemistry correlates of amphibian breeding ponds in northern Wisconsin USA. In: Hydrobiologia, Band 208, 1990, S. 153–160, (Digitalisat).
Weblinks
- Informationen bei amphibiaweb.org (englisch)
- Animal Diversity Web - University of Michigan: Ambystoma laterale (englisch)