Bispezifischer Antikörper
Ein bispezifischer Antikörper (Abkürzung: BsMAb von englisch bispecific monoclonal antibody), auch als Hybrid-Antikörper bezeichnet, ist ein Immunkonjugat, das aus Bestandteilen von zwei unterschiedlichen monoklonalen Antikörpern aufgebaut ist. Bispezifische Antikörper sind ein potenzielles Therapiekonzept in der Krebsimmuntherapie und Gegenstand von klinischen Studien.
Aufbau und Wirkungsmechanismus
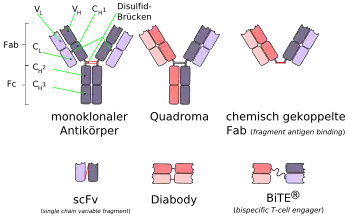
Ein bispezifischer Antikörper der ersten Generation – auch als Quadroma bezeichnet – besteht aus je einer schweren und einer leichten Kette zweier unterschiedlicher monoklonaler Antikörper. Die beiden Arme des Antikörpers sind dabei gegen jeweils andere Antigene gerichtet. Der Fc-Teil (der „Fuß“ des Antikörpers) wird gemeinsam aus den beiden schweren Ketten der Antikörper gebildet und stellt die dritte Bindungsstelle des bispezifischen Antikörpers dar. Durch diesen Aufbau ist es beispielsweise möglich das Paratop eines gegen ein Tumorantigen gerichteten Antikörpers und das Paratop eines anderen gegen ein Lymphozyten-Antigen gerichteten Antikörpers, auf je einem Arm des bispezifischen Antikörpers zu platzieren. Bei diesem Beispiel ist es dann möglich, dass der Antikörper an eine Tumorzelle mit dem entsprechenden Tumorantigen und an einen Lymphozyten bindet. Über den Fc-Abschnitt des bispezifischen Antikörpers können dann noch antigenpräsentierende Zellen wie beispielsweise B-Zellen oder Makrophagen binden und einen Drei-Zell-Komplex bilden. Durch diesen Drei-Zell-Komplex ergibt sich im Regelfall eine verbesserte Aktivierung der körpereigenen Immunzellen gegenüber den Tumorzellen.
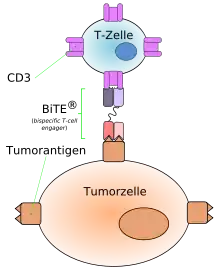
Von diesem Aufbau weichen die bispezifischen Antikörper der neueren Generation ab. Sie können aus zwei scFv-Fragmenten (Fragmente monoklonaler Antikörper) aufgebaut sein. Beispielsweise kann so ein auf das Antigen CD3 ausgerichteter Antikörper mit dem zweiten Paratop, mit geringerer Affinität,[1] auch an T-Zellen binden und erst im Fall der Bindung an die Tumorzelle mit dem CD3-Antigen, die T-Zelle aktivieren.[2] Man spricht in diesen Fällen von bispezifischen Antikörpern zur Rekrutierung von Effektorzellen.[3] Dieses Konzept wird „BiTE“ (engl.: bispecific T-cell engager) genannt.[4][5][6]
Vorteile gegenüber monoklonalen Antikörpern
Wird ein Paratop gegen T-Zellen gerichtet, so können auch diese Zellen aktiviert werden. Mit normalen monoklonalen Antikörpern ist dies nicht möglich, da T-Zellen über keine Fc-Rezeptoren verfügen.[7] Bispezifische Antikörper weisen darüber hinaus ein höheres zytotoxisches Potenzial auf. Sie binden auch an Antigene, die relativ schwach exprimiert werden.[8][9] Die notwendige Dosis pro Patient liegt im Bereich von 0,01 mg·m−2·d−1 und ist um mehrere Größenordnungen niedriger als bei monoklonalen Antikörpern.[7]
Herstellung
Bispezifische Antikörper kommen in normalen Lebewesen nicht vor, weshalb sie künstlich hergestellt werden müssen. Die ersten Konzepte für bispezifische Antikörper stammen aus der Mitte der 1980er Jahre.[10] In der Folge wurden die ersten bispezifischen Antikörper in extrem aufwändiger Weise hergestellt, was die Weiterentwicklung dieses Konzeptes für viele Jahre erheblich einschränkte. Eines der Verfahren ist die Fusion von zwei Hybdridomen mit der Hybridom-Technik (Quadroma-Technik).[11] Eine andere Variante ist die chemische Kopplung zweier Antikörper oder Antikörper-Fragmente.[3][12][13][14][15][16]
Mit Hilfe gentechnischer Verfahren ist die Synthese auch von größeren Mengen bispezifischer Antikörper für therapeutische Anwendungen mittlerweile möglich. Insbesondere die rekombinante Herstellung bispezifischer Antikörper aus Antikörperfragmenten ist das gegenwärtig etablierte Herstellungsverfahren. Ein BiTE-Antikörper kann über vier codierende Gene zu einem einzelnen Protein mit ungefähr 55 kDa molarer Masse rekombinant hergestellt werden.[17]
Entwicklungsstatus
Die klinischen Ergebnisse mit der ersten Generation bispezifischer Antikörper konnten die anfänglichen Erwartungen nicht erfüllen.[18] Ursache hierfür waren die geringe Wirksamkeit – unter anderem wegen einer sehr kurzen Plasmahalbwertszeit der Hybrid-Antikörper[8] – und deren Immunogenität. Die Quadroma-Antikörper zeigten in ersten klinischen Studien bei einem Teil der Patienten einen therapeutischen Effekt.[19][20][21] Die Immunogenität – bedingt durch die murinen Bestandteile des bispezifischen Antikörpers – führte allerdings zu einer Humanen-Anti-Maus-Antikörper-Antwort, mit der Ausschüttung von HABA (human-anti-bispecific antibodies). Dies schloss eine längere Behandlung mit bispezifischen Antikörpern aus.[3][22] Außerdem bewirkte der Fc-Teil der Quadroma-Antikörper eine Kreuzvernetzung mit verschiedenen Fc-Rezeptoren, wodurch es zu einer stark erhöhten Freisetzung von Zytokinen und dadurch bedingt zu heftigen Nebenwirkungen kam.[9][23][24]
Bessere Ergebnisse – mit weniger Nebenwirkungen – konnten bei chemisch miteinander verbundenen bispezifischen Fab-Fragmenten erzielt werden. Die klinischen Studien verliefen recht vielversprechend.[18][25][26][27][28] Das aufwändige und dadurch sehr kostspielige Herstellungsverfahren führte letztlich dazu, dass keine umfangreicheren klinischen Studien (Phase III) durchgeführt wurden.[3] Das Interesse am Konzept der bispezifischen Antikörper ließ in der Folgezeit merklich nach.
Erste Vertreter
Durch die Entwicklung des BiTE-Konzeptes ist das Interesse an bispezifischen Antikörpern in den letzten Jahren wieder erheblich gestiegen.
- 2009 wurde der erste in Hybridom-Technik hergestellte bispezifische Antikörper für die Anwendung beim Menschen zugelassen, und zwar Catumaxomab für die Behandlung der bösartigen Bauchwassersucht.[29]
- In der EU zugelassen ist seit November 2015 Blinatumomab (Blincyto) der Firma Amgen, ein Antikörper der gegen CD3 und CD19 gerichtet ist. Er wird bei Patienten in späten Phasen des Non-Hodgkin-Lymphoms[7] und bei Patienten mit akuter lymphoblastischer Leukämie der B-Zellreihe (B-ALL) eingesetzt.[30]
Weitere Kandidaten
Gegenwärtig (Stand 2017) befinden sich mindestens zwei weitere BiTE-Antikörper in der klinischen Entwicklung (Phase III):
- Solitomab (MT110) der Firma Amgen, gerichtet gegen die Antigene CD3 und EpCAM (engl.: epithelial cell adhesion molecule) und soll gegen das Bronchialkarzinom und gastrointestinale Krebserkrankungen wirksam sein.[6][31][32][33][34]
- Emicizumab (ACE910) der Firma Roche, zur Behandlung der Hämophilie A (mit Inhibitoren).[35][36] Emicizumab wurde im November 2017 seitens der FDA zugelassen.[37] Die Zulassung für Europa steht noch aus.[38]
Siehe auch
Literatur
Fachbücher
- C. Huber u. a. (Hrsg.): Krebsimmuntherapien. Deutscher Ärzteverlag, 2007, ISBN 978-3-7691-1212-2.
Review-Artikel
- P. Bühler, U. Elsässer-Beile: Bispecific antibodies and diabodies for cancer immunotherapy. In: Immunotherapy. Vol 4, Nr. 5, 2012, S. 459–460. PMID 22642325
- R. Repp u. a.: Bispezifische Antikörper in der Hämatologie und Onkologie. In: Internist (Berl)., Band 42, 2001, S. 854–859. PMID 11449632
- S. L. Morrison: Two heads are better than one. In: Nature Biotechnology, Band 25, 2007, S. 1233–1234. PMID 17989683
- N. Fischer, O. Léger: Bispecific antibodies: molecules that enable novel therapeutic strategies. In: Pathobiology, Band 74, 2007, S. 3–14. PMID 17496428
- J. S. Marvin, Z. Zhu: Recombinant approaches to IgG-like bispecific antibodies. In: Acta Pharmacol Sin., Band 26, 2005, S. 649–658. PMID 15916729
- M. W. Fanger u. a.: Production and use of anti-FcR bispecific antibodies. In: Immunomethods, Band 4, 1994, S. 72–81. PMID 8069530
- P. Chames, D. Baty: Bispecific antibodies for cancer therapy. In: Curr Opin Drug Discov Devel., Band 12, 2009, S. 276–283. PMID 19333873
- M. R. Suresh u. a.: Advantages of bispecific hybridomas in one-step immunocytochemistry and immunoassays. In: PNAS. Band 83, 1986, S. 7989–7993. PMID 2429324
Fachartikel
- P. Kufer u. a.: A revival of bispecific antibodies. In: Trends Biotechnol. Band 22, 2004, S. 238–244. PMID 15109810
- S. Dincq u. a.: Expression and purification of monospecific and bispecific recombinant antibody fragments derived from antibodies that block the CD80/CD86-CD28 costimulatory pathway. In: Protein Expr Purif. Band 22, 2001, S. 11–24. PMID 11388794
- P. W. Parren, D. R. Burton: Immunology. Two-in-one designer antibodies. In: Science, Band 323, 2009, S. 1567–1578. PMID 19299606
- D. Rüttinger u. a.: BiTE®-Antikörper: Durch Bispezifität T-Lymphozyten gegen Tumorzellen richten. In: Journal Onkologie. Online-Ausgabe, April 2008.
Weblinks
Einzelnachweise
- T. Dreier u. a.: Extremely potent, rapid and costimulation-independent cytotoxic T-cell response against lymphoma cells catalyzed by a single-chain bispecific antibody. In: International Journal of Cancer. Band 100, 2002, S. 690–697. PMID 12209608
- K. Brischwein u. a.: Strictly target celldependent activation of T cells by bispecific single-chain antibody constructs of the BiTE class. In: Journal of Immunotherapy. Band 30, 2007, S. 798–807. PMID 18049331
- C. Kellner: Entwicklung und Charakterisierung bispezifischer Antikörper-Derivate zur Immuntherapie CD19-positiver Leukämien und Lymphome. Dissertation. Friedrich-Alexander-Universität Erlangen-Nürnberg, 2008.
- P. A. Baeuerle, C. Reinhardt, P. Kufer: BiTE: A new class of antibodies that recruit T-cells. In: Drugs of the Future. Band 33, Nr. 2, 2008, S. 137–147, doi:10.1358/dof.2008.033.02.1172578.
- P. A. Baeuerle u. a.: BiTE: Teaching antibodies to engage T cells for cancer therapy. In: Curr Opin Mol Ther. Band 11, 2009, S. 22–30. PMID 19169956 (Review)
- P. A. Baeuerle, C. Reinhardt: Bispecific T-cell engaging antibodies for cancer therapy. In: Cancer Research. Band 69, 2009, S. 4941–4944. PMID 19509221 (Review)
- R. Bargou u. a.: Tumor regression in cancer patients by very low doses of a T cell-engaging antibody. In: Science. Band 321, 2008, S. 974–977. PMID 18703743
- M. Peipp, T. Valerius: Bispecific antibodies targeting cancer cells. In: Biochem Soc Trans. Band 30, 2002, S. 507–511. PMID 12196124 (Review)
- L. M. Weiner u. a.: Binding and cytotoxicity characteristics of the bispecific murine monoclonal antibody 2B1. In: J Immunol. Band 151, 1993, S. 2877–2886. PMID 8103070
- U. D. Staerz u. a.: Hybrid antibodies can target sites for attack by T cells. In: Nature. Band 314, 1985, S. 628–631. PMID 2859527
- P. Borchmann u. a.: Monoklonale Antikörper: Entwicklung und klinische Perspektiven. In: Der Internist. Band 42, 2001, S. 803–814. doi:10.1007/s001080170123.
- M. J. Glennie u. a: Preparation and performance of bispecific F(ab’ gamma)2 antibody containing thioether-linked Fab’ gamma fragments. In: J Immunol. Band 139, 1987, S. 2367–2375. PMID 2958547
- B. Karpovsky u. a.: Production of target-specific effector cells using hetero-cross-linked aggregates containing anti-target cell and anti-Fc gamma receptor antibodies. In: J Exp Med. Band 160, 1984, S. 1686–1701. PMID 6239899
- C. Milstein, A. C. Cuello: Hybrid hybridomas and their use in immunohistochemistry. In: Nature. Band 305, 1983, S. 537–540. PMID 6137772
- D. Schrama u. a.: Antibody targeted drugs as cancer therapeutics. In: Nat Rev Drug Discov. Band 5, 2006, S. 147–159. PMID 16424916
- M. R. Suresh u. a.: Bispecific monoclonal antibodies from hybrid hybridomas. In: Methods Enzymol. Band 121, 1986, S. 210–228. PMID 3724461
- I. Heisler: Bedeutung spaltbarer Peptidlinker für die Funktion rekombinanter Saporin-EGF-Immunotoxine. Berlin 2008, DNB 968622887, urn:nbn:de:kobv:188-2003002108 (Dissertation).
- R. T. Curnow: Clinical experience with CD64-directed immunotherapy. An overview. In: Cancer Immunol Immunother. Band 45, 1997, S. 210–215. PMID 9435876 (Review)
- S. Canevari u. a.: Bispecific antibody targeted T cell therapy of ovarian cancer: clinical results and future directions. In: J Hematother. Band 4, 1995, S. 423–427. PMID 8581379
- C. H. Lamers u. a.: Local but no systemic immunomodulation by intraperitoneal treatment of advanced ovarian cancer with autologous T lymphocytes re-targeted by a bi-specific monoclonal antibody. In: Int J Cancer. Band 73, 1997, S. 211–219. PMID 9335445
- D. M. Segal u. a.: Bispecific antibodies in cancer therapy. In: Curr Opin Immunol. Band 11, 1999, S. 558–562. PMID 10508714 (Review)
- F. Hartmann u. a.: Treatment of refractory Hodgkin’s disease with an anti-CD16/CD30 bispecific antibody. In: Blood. Band 89, 1997, S. 2042–2047. PMID 9058726
- L. M. Weiner u. a.: Phase I trial of 2B1, a bispecific monoclonal antibody targeting c-erbB-2 and Fc gamma RIII. In: Cancer Res. Band 55, 1995, S. 4586–4593. PMID 7553634
- B. K. Link u. a.: Anti-CD3-based bispecific antibody designed for therapy of human B-cell malignancy can induce T-cell activation by antigen-dependent and antigen-independent mechanisms. In: Int J Cancer. Band 77, 1998, S. 251–256. PMID 9650561
- P. Borchmann u. a.: Phase 1 trial of the novel bispecific molecule H22xKi-4 in patients with refractory Hodgkin lymphoma. In: Blood. Band 100, 2002, S. 3101–3107. PMID 12384405
- N. D. James u. a.: A phase II study of the bispecific antibody MDX-H210 (anti-HER2 x CD64) with GM-CSF in HER2+ advanced prostate cancer. In: Br J Cancer. Band 85, 2001, S. 152–156. PMID 11461069
- J. A. Posey u. a.: A pilot trial of GM-CSF and MDX-H210 in patients with erbB-2-positive advanced malignancies. In: J Immunother. Band 22, 1999, S. 371–379. PMID 10404439
- F. H. Valone u. a.: Phase Ia/Ib trial of bispecific antibody MDX-210 in patients with advanced breast or ovarian cancer that overexpresses the proto-oncogene HER-2/neu. In: J Clin Oncol. Band 13, 1995, S. 2281–2292. PMID 7545221
- Zulassung von Removab® (Eintrag bei der EMA)
- FDA Grants Full Approval for BLINCYTO® (blinatumomab) to Treat Relapsed or Refractory B-cell Precursor Acute Lymphoblastic Leukemia in Adults and Children. Pressemitteilung Amgen, 11. Juli 2017, abgerufen am 13. Juli 2017.
- K. Brischwein u. a.: MT110: a novel bispecific single-chain antibody construct with high efficacy in eradicating established tumors. In: Mol Immunol. Band 43, 2006, S. 1129–1143. PMID 16139892
- Caroline Helwick: Novel BiTE antibody mediates contact between T cells and cancer cells. In: Oncology NEWS International. Band 17, Nr. 6, 1. Juni 2008 (cancernetwork.com).
- NCT00635596 Phase I Study of MT110 in Colorectal Cancer (CRC), Gastrointestinal (GI) and Lung Cancer (MT110-101) ClinicalTrials.gov
- M. Amann, S. d’Argouges, G. Lorenczewski, K. Brischwein, R. Kischel, R. Lutterbuese, S. Mangold, D. Rau, J. Volkland, S. Pflanz, T. Raum, M. Münz, P. Kufer, B. Schlereth, P. A. Baeuerle, M. Friedrich: Antitumor Activity of an EpCAM/CD3-bispecific BiTE Antibody During Long-term Treatment of Mice in the Absence of T-cell Anergy and Sustained Cytokine Release. In: Journal of Immunotherapy. Band 32, Nr. 5, 2009, S. 452–464, doi:10.1097/CJI.0b013e3181a1c097, PMID 19609237.
- Positive phase III results for Roche’s emicizumab in haemophilia A published in The New England Journal of Medicine. Pressemitteilung Roche, 10. Juli 2017; abgerufen am 13. Juli 2017.
- Roche’s Hemlibra significantly reduced bleeds in phase III study in haemophilia A. Pressemitteilung Roche, 20. November 2017; abgerufen am 22. November 2017.
- FDA approves new treatment to prevent bleeding in certain patients with hemophilia A. Pressemitteilung FDA, 16. November 2017; abgerufen am 22. November 2017.
- FDA approves Roche’s Hemlibra (emicizumab-kxwh) for haemophilia A with inhibitors. Pressemitteilung Roche, 16. November 2017; abgerufen am 22. November 2017.