Blinatumomab
Blinatumomab (Handelsname Blincyto; Hersteller Amgen) ist ein bispezifischer Antikörper, der gleichzeitig gegen den CD3-Rezeptor der T-Zellen und gegen das Oberflächenprotein CD19 der B-Zellen gerichtet ist. Er wird als biopharmazeutischer Arzneistoff in der Krebsmedizin (Onkologie) zur Krebsimmuntherapie zur Behandlung spezieller Formen der akuten lymphatischen Leukämie (ALL) eingesetzt. Blinatumomab ist zugleich der erste therapeutisch verwendete sogenannte BiTE-Antikörper.
| Blinatumomab | ||
|---|---|---|
| Masse/Länge Primärstruktur | 54,1 kDa | |
| Bezeichner | ||
| Externe IDs |
| |
| Arzneistoffangaben | ||
| Wirkstoffklasse | Krebsimmuntherapeutikum | |
Klinische Angaben
Anwendungsgebiete (Indikationen)
BLINCYTO wird angewendet zur Behandlung von Erwachsenen mit Philadelphia-Chromosom negativer, rezidivierter oder refraktärer B-Vorläufer akuter lymphatischer Leukämie (ALL).
Art und Dauer der Anwendung
Die Behandlung sollte unter der Leitung und Überwachung eines Arztes erfolgen, der in der Behandlung hämatologischer Malignome erfahren ist.
Pharmakologische Eigenschaften
Wirkungsmechanismus (Pharmakodynamik)
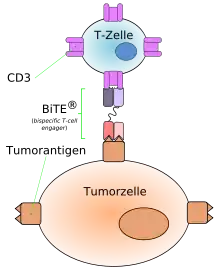
Blinatumomab ist ein BiTE-Antikörper und besteht aus zwei Antigen-erkennenden scFv-Fragmenten, die über eine Peptidbrücke miteinander verbunden sind. Eines der zwei scFv-Fragmente bindet spezifisch an den CD3-Rezeptor der T-Zellen. Das zweite scFv-Fragment ist gegen das Antigen CD19 gerichtet, das auf allen B-Zellen exprimiert wird. Im Falle einer B-Zell-Neoplasie werden somit die Tumorzellen durch CD19 erkannt. Durch die Bindung an die Zielproteine CD3 und CD19 führen diese BiTE-Antikörper zu einer Kopplung der malignen B-Zelle an eine T-Zelle. Die T-Zelle wird auf diese Weise aktiviert und beginnt zytotoxische Proteine, wie das porenbildende Protein Perforin und Granzyme, welche den programmierten Zelltod (Apoptose) auslösen, zu produzieren und freizusetzen. Als Folge wird die maligne B-Zelle zerstört. Die T-Zell-vermittelte Erkennung und Zerstörung maligner B-Zellen unter Verwendung von BiTE-Antikörpern ist unabhängig von der Beteiligung des Haupthistokompatibilitätskomplex (MHC). Somit kann ein möglicher Tumor-Resistenzmechanismus, die verringerte Expression von MHC-Proteinen im Tumorgewebe, umgangen werden.[1]
Erste Ergebnisse aus klinischen Studien der Phasen I und II deuten auf eine Übertragbarkeit der experimentell-pharmakologischen Eigenschaften für einen Anti-Tumor-Effekt von Blinatumomab im Menschen.[1] Dieser BiTE-Antikörper zeigte in einer klinischen Studie der Phase II eine Anti-Tumor-Wirkung bei der akuten lymphatischen Leukämie (ALL).[2][3] Ein teilweiser oder ganzer Tumorrückgang konnte in der initialen „Proof-of-Concept“-Studie für die Substanz auch bei Patienten mit einem Non-Hodgkin-Lymphom beobachtet werden.[4]
Zulassungsaspekte
Zulassungsstatus
Blincyto wurde in der EU im November 2015 zugelassen.[5] Die Zulassung in den USA war bereits im Dezember 2014 erfolgt.[6] Von der US-amerikanischen Zulassungsbehörde FDA erhielt Blinatumomab die Breakthrough Therapy Designation (engl. für ‚Durchbruch in der Therapie‘) und wurde sowohl in den USA als auch in der EU als Orphan Drug (Arzneimittel für seltene Leiden) ausgewiesen.[5][6][7]
Overall Survival Data
Im Juni 2018 erhielt Amgen die Genehmigung seitens der Europäischen Zulassungsbehörde (EMA), sogenannte Overall Survival Data zulassungsrelevant zu publizieren. BLINCYTO ist die erste Immuntherapie mit einem einzigen Wirkstoff, die einen überlegenen Gesamtüberlebensvorteil gegenüber der Standardtherapie aufweist. Seit Jahrzehnten ist das Gesamtüberleben der Goldstandard für die Beurteilung der Wirksamkeit von Blutkrebsbehandlungen.[8]
Sicherheitsaspekte
Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung zu melden. Der pharmazeutische Hersteller Amgen hat dazu eine eigene WebSite zur Risikominimierung eingerichtet (s. Weblinks).
Geschichte
Blinatumomab wurde ursprünglich von dem deutschen Biotechnologie-Unternehmen Micromet entwickelt. Aufgrund einer Übernahme 2012 durch das Biotechnologie-Unternehmen Amgen gelangte er in die Forschungs-Pipeline von Amgen.[9] Im Juli 2014 erhielt Amgen für Blinatumomab von der US-amerikanischen Arzneimittelzulassungsbehörde FDA die sogenannte Breakthrough Therapy Designation.[10] In Anerkennung der Studienlage und der Notwendigkeit für neue Medikamente zur Behandlung der ALL bedeutet eine Breakthrough Therapy Designation u. a. ein beschleunigtes Zulassungsverfahren. Im Oktober 2014 erhielt Blinatumomab die Priority Review Designation.[11] Die arzneimittelrechtliche Zulassung zur Behandlung der rezidivierten oder refraktären B-Vorläufer-ALL durch die FDA für den US-amerikanischen Markt erfolgte im Dezember 2014.[12]
Weblinks
- www.blincyto-rm.de (Risikominimierung)
- Öffentlicher Beurteilungsbericht (EPAR) der europäischen Arzneimittelagentur (EMA) zu: Blinatumomab
Einzelnachweise
- Baeuerle PA, Reinhardt C: Bispecific T-cell engaging antibodies for cancer therapy. In: Cancer Res.. 69, Nr. 12, Juni 2009, S. 4941–4. doi:10.1158/0008-5472.CAN-09-0547. PMID 19509221.
- Topp M, Goekbuget N, Kufer P, et al.: Treatment with anti-CD19 BiTE antibody blinatumomab (MT103/MEDI-538) is able to eliminate minimal residual disease (MRD) in patients with B-precursor acute lmphoblastic leukemia (ALL): First results of ongoing phase 2 study [ASH Annual Meeting Abstract]. In: Blood. 112, 2008, S. 1926.
- Topp MS, Kufer P, Gökbuget N, et al.: Targeted therapy with the T-cell-engaging antibody blinatumomab of chemotherapy-refractory minimal residual disease in B-lineage acute lymphoblastic leukemia patients results in high response rate and prolonged leukemia-free survival. In: J Clin Oncol.. 29, 2011, S. 2493.
- Bargou R, Leo E, Zugmaier G, et al.: Tumor regression in cancer patients by very low doses of a T cell-engaging antibody. In: Science. 321, Nr. 5891, August 2008, S. 974–7. doi:10.1126/science.1158545. PMID 18703743.
- European Commission Approves Amgen's BLINCYTO® (blinatumomab) for the Treatment of Adults with Philadelphia Chromosome-Negative Relapsed or Refractory B-precursor Acute Lymphoblastic Leukemia (Memento vom 24. November 2015 im Internet Archive), PM AMGEN vom 24. November 2015, abgerufen am 24. November 2015.
- Blinatumomab, Meldung der FDA vom 3. Dezember 2014, abgerufen am 24. November 2015.
- FDA Approves BLINCYTO™ (Blinatumomab) Immunotherapy for the Treatment of Relapsed or Refractory B-Cell Precursor Acute Lymphoblastic Leukemia, PM AMGEN vom 3. Dezember 2015, abgerufen am 24. November 2015.
- Amgen Receives European Commission Approval To Add Overall Survival Data To BLINCYTO® (blinatumomab) Label (Memento vom 27. Juni 2018 im Internet Archive), PM Amgen vom 19. Juni 2018, abgerufen am 21. Juni 2018.
- Übernahme von Micromet durch Amgen, PM von Amgen vom 26. Januar 2012, abgerufen am 2. Juli 2014.
- Amgen Receives FDA Breakthrough Therapy Designation For Investigational BiTE® Antibody Blinatumomab In Acute Lymphoblastic Leukemia, PM von Amgen vom 1. Juli 2014, abgerufen am 2. Juli 2014.
- Amgen's BiTE® Immunotherapy Blinatumomab Receives FDA Priority Review Designation In Acute Lymphoblastic Leukemia, PM von Amgen vom 9. Oktober 2014, abgerufen am 10. Oktober 2014.
- U.S. Food and Drug Administration: Blinatumomab. 3. Dezember 2014. Abgerufen am 23. Februar 2015..