BiTE-Antikörper
BiTE-Antikörper (von engl. Bi-specific T-cell engagers) sind künstliche bispezifische monoklonale Antikörper. Sie bestehen aus zwei scFv-Fragmenten, die über eine Peptidbrücke miteinander verbunden sind. Eines der zwei scFv-Fragmente weist eine Selektivität für ein Antigen auf einer Zielzelle auf. Das andere scFv-Fragment ist in der Lage, spezifisch an Oberflächenproteine von T-Zellen zu binden. Auf diese Weise kann mit Hilfe von BiTE-Antikörpern gezielt eine T-Zell-vermittelte Immunantwort gegen bestimmte Zielzellen, wie beispielsweise Tumorzellen, gesteuert werden. Daher werden BiTE-Antikörper, die maßgeblich von dem Biotechnologie-Unternehmen Micromet (2012 von Amgen gekauft) entwickelt wurden, als eine neue Option in der Tumortherapie erforscht. Blinatumomab ist der erste therapeutisch verwendete BiTE-Antikörper.
Struktur
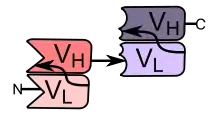
BiTE-Antikörper bestehen aus zwei scFv-Fragmenten und haben eine Molekülmasse von etwa 55 kDa. Jedes der scFv-Fragmente besteht aus je einer variablen Domäne der leichten (VL) und einer variablen Domäne der schweren Kette (VH) eines konventionellen monoklonalen Antikörpers. Diese insgesamt vier Domänen sind über Peptidbrücken zu einer einzigen Aminosäurekette miteinander verbunden. Für die Entwicklung und Herstellung ist diese strukturelle Eigenschaft ein Vorteil gegenüber konventionellen, aus insgesamt vier Ketten bestehenden IgG-Antikörpern. BiTE-Antikörper können mit Hilfe molekularbiologischer Methoden zusammengestellt, durch ein einziges Gen codiert und mit üblichen biotechnologischen Verfahren unter Verwendung eukaryotischer Zelllinien gewonnen werden.[1]
Funktion
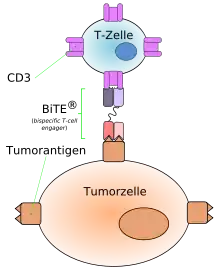
Die zwei scFv-Fragmente, aus denen ein BiTE-Antikörper aufgebaut ist, sind in der Lage, bispezifisch an zwei voneinander verschiedene Zielproteine zu binden. Ein scFv-Fragment bindet definitionsgemäß immer an ein Oberflächenprotein der T-Zellen, üblicherweise dem CD3-Rezeptor. Das zweite scFv-Fragment ist gegen ein Oberflächenprotein gerichtet, das möglichst selektiv auf der Zielzelle exprimiert wird. Durch die Bindung an die entsprechenden Zielproteine führen BiTE-Antikörper zu einer Verlinkung einer Zielzelle mit einer T-Zelle. Die T-Zelle wird auf diese Weise aktiviert und beginnt zytotoxische Proteine, wie das porenbildende Protein Perforin und Granzyme, welche den programmierten Zelltod (Apoptose) auslösen, zu produzieren und freizusetzen. Als Folge wird die Zielzelle zerstört.
Dieser Mechanismus ist der natürlichen Funktion der zytotoxischen T-Zellen nachempfunden. Die T-Zell-vermittelte Erkennung und Zerstörung einer Zielzelle unter Verwendung von BiTE-Antikörpern ist jedoch unabhängig von der Beteiligung des Haupthistokompatibilitätskomplex (MHC).[1]
Verwendung
BiTE-Antikörper werden insbesondere als eine mögliche neue Option in der Tumortherapie diskutiert. Der BiTE-Antikörper Blinatumomab, der gegen CD3 und CD19 gerichtet ist, wird derzeit in klinischen Studien getestet. Weitere BiTE-Antikörper gegen CD3 und EpCAM, HER2/neu, EGFR, CD66e, CD33, EphA2 bzw. MCSP befinden sich in der Entwicklung.[1] Blinatumomab wurde im November 2015 in der EU zur Behandlung spezieller Formen der akuten lymphatischen Leukämie (ALL) zugelassen.[2] Die Zulassung in den USA war bereits im Dezember 2014 erfolgt.[3]
Einzelnachweise
- Baeuerle PA, Reinhardt C: Bispecific T-cell engaging antibodies for cancer therapy. In: Cancer Res.. 69, Nr. 12, Juni 2009, S. 4941–4. doi:10.1158/0008-5472.CAN-09-0547. PMID 19509221.
- European Commission Approves Amgen's BLINCYTO® (blinatumomab) for the Treatment of Adults with Philadelphia Chromosome-Negative Relapsed or Refractory B-precursor Acute Lymphoblastic Leukemia, PM AMGEN vom 24. November 2015, abgerufen am 24. November 2015.
- Blinatumomab, Meldung der FDA vom 3. Dezember 2014, abgerufen am 24. November 2015.
Literatur
- Rüttinger D, Zugmaier G, Nagorsen D, Reinhardt C, Baeuerle PA: BiTE®-Antikörper: Durch Bispezifität T-Lymphozyten gegen Tumorzellen richten. In: Journal Onkologie. Nr. 4, 2008.
- Kate L. Lowe, David Cole, Rupert Kenefeck, Ita OKelly, Marco Lepore, Bent K. Jakobsen: Novel TCR-based biologics: mobilising T cells to warm ‘cold’ tumours. Cancer Treatment Reviews, Bd. 77, 2019, S. 35–43 doi:10.1016/j.ctrv.2019.06.001 (englisch)