Bismut(V)-fluorid
Bismut(V)-fluorid ist eine anorganische chemische Verbindung des Bismuts aus der Gruppe der Fluoride.
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
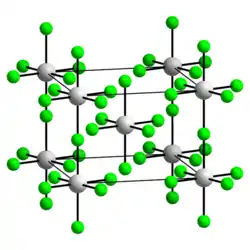 | ||||||||||||||||
| _ Bi5+ _ F− | ||||||||||||||||
| Kristallsystem |
tetragonal | |||||||||||||||
| Raumgruppe |
I4/m (Nr. 87) | |||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Bismut(V)-fluorid | |||||||||||||||
| Andere Namen |
Bismutpentafluorid | |||||||||||||||
| Verhältnisformel | BiF5 | |||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 303,97 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte |
5,40 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
230 °C[2] | |||||||||||||||
| Sublimationspunkt | ||||||||||||||||
| Löslichkeit |
reagiert mit Wasser[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Bismut(V)-fluorid kann durch Reaktion von Bismut(III)-fluorid oder Bismut mit Fluor bei Temperaturen über 500 °C bzw. 600 °C gewonnen werden.[3]
Eigenschaften
Bismut(V)-fluorid ist ein weißer, sehr feuchtigkeitsempfindlicher, kristalliner Feststoff. Er färbt sich an feuchter Luft sofort gelb bis braun. Mit Wasser reagiert es mitunter unter Feuererscheinung, wobei sich Ozon und Bismut(III)-fluorid bilden. Oberhalb 50 °C reagiert es mit Paraffinöl.[3] Es hat eine tetragonale Kristallstruktur mit der Raumgruppe I4/m (Raumgruppen-Nr. 87)[5] und bildet eine Struktur mit linearen Ketten.[6] Es ist ein extrem starkes Fluorierungsmittel und bildet mit Alkalimetallfluoriden Hexafluorobismutate(V) M[BiF6].[7] Mit Xenondifluorid als starker Fluoriddonor werden in einer Fluoridtransferreaktion je nach Mischungsverhältnis verschiedene ionische Verbindungen gebildet.[8]
Verwendung
Bismut(V)-fluorid wird als Fluorierungsmittel verwendet.[2]
Einzelnachweise
- Datenblatt Bismuth(V) fluoride, 99.9% trace metals basis bei Sigma-Aldrich, abgerufen am 23. September 2013 (PDF).
- Dale L. Perry: Handbook of Inorganic Compounds, Second Edition. Taylor & Francis US, 2011, ISBN 1-4398-1462-7, S. 483 (eingeschränkte Vorschau in der Google-Buchsuche).
- Georg Brauer, unter Mitarbeit von Marianne Baudler u. a. (Hrsg.): Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I. Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 219.
- A. F. Holleman, N. Wiberg: Anorganische Chemie. 103. Auflage. 1. Band: Grundlagen und Hauptgruppenelemente. Walter de Gruyter, Berlin / Boston 2016, ISBN 978-3-11-049585-0, S. 952 (Leseprobe: Teil A – Grundlagen der Chemie Der Wasserstoff. Google-Buchsuche).
- Jean d’Ans, Ellen Lax, Roger Blachnik: Taschenbuch für Chemiker und Physiker. Springer DE, 1998, ISBN 3-642-58842-5, S. 336 f. (eingeschränkte Vorschau in der Google-Buchsuche).
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 816.
- Erwin Riedel, Christoph Janiak: Anorganische Chemie. Walter de Gruyter, 2011, ISBN 3-11-022566-2, S. 511 (eingeschränkte Vorschau in der Google-Buchsuche).
- Ralf Steudel: Chemie der Nichtmetalle. Synthesen – Strukturen – Bindung – Verwendung. 4. Auflage. Walter de Gruyter, Berlin/Boston 2014, ISBN 978-3-11-030439-8, S. 570.

