Berylliumacetat
Berylliumacetat ist eine chemische Verbindung aus der Gruppe des Berylliumverbindungen und Acetate mit der Konstitutionsformel Be(CH3COO)2.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
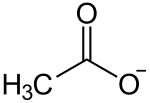 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Berylliumacetat | |||||||||||||||
| Andere Namen |
Berylliumdiacetat | |||||||||||||||
| Summenformel | C4H6BeO4 | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 127,10 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Schmelzpunkt |
> 60 °C (Zersetzung)[1] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Berylliumacetat kann durch Reaktion von Berylliumoxidacetat in Eisessig mit Acetylchlorid gewonnen werden.[5] Das Berylliumoxidacetat wird durch Reaktion von wasserfreiem Berylliumchlorid und Essigsäureanhydrid hergestellt.[6]
Eigenschaften
Berylliumacetat ist ein nicht brennbarer Feststoff, welcher sich beim langsamen Erhitzen ab 60 – 100 °C, beim schnellen Erhitzen ab 150 – 180 °C zersetzt.[1] Es gibt langsam, beim Erhitzen schnell Essigsäureanhydrid ab und geht in Berylliumoxidacetat über,[6] welches sublimiert.[2]
Beim schnellen Erhitzen erfolgt teilweise Zersetzung zu Essigsäureanhydrid und Berylliumoxid.[6]
Von kaltem Wasser wird es kaum angegriffen, hydratisiert aber in heißem Wasser.[2]
Verwandte Verbindungen
- basisches Berylliumacetat Be4O(CH3COO)6[7]
Einzelnachweise
- Eintrag zu Berylliumacetat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- C. L. Parsons: The Chemistry and Literature of Beryllium. Chemical Publishing, Easton 1909, OCLC 4328587, S. 40. (Volltext)
- Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag beryllium compounds with the exception of aluminium beryllium silicates, and with those specified elsewhere in this Annex im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Environmental Health Criteria (EHC) für Beryllium, abgerufen am 29. November 2014.
- Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 899.
- Kenneth A. Walsh: Beryllium chemistry and Processing. ASM International, 2009, ISBN 978-0-87170-721-5, S. 123f. (eingeschränkte Vorschau in der Google-Buchsuche).
- T. Moeller, A. J. Cohen, E. Marvell: Basic Beryllium Acetate and Propionate. In: Inorganic Syntheses. 1950, Volume 3, S. 4–11. doi:10.1002/9780470132340.ch2


