Atriales natriuretisches Peptid
Atriales natriuretisches Peptid (ANP, auch bekannt als atrialer natriuretischer Faktor (ANF), ältere Bezeichnungen sind Atriopeptin, natriuretisches Peptid Typ A, Cardionatrine, CDD, Cardiodilatin oder Vorhof-Natriuretischer Faktor) ist ein Peptidhormon, das zum größten Teil von den Muskelzellen (Myocyten) des Herzvorhofes (Atrium) aufgrund von Dehnungsreizen ausgeschüttet wird. Es bewirkt eine Steigerung der Harnausscheidung. Daran gekoppelt ist eine Natriumionen ausschwemmende (natriuretische) Wirkung.
| Atriales natriuretisches Peptid | ||
|---|---|---|
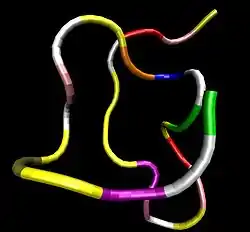 | ||
| 3D-Struktur einer ANP-Variante.[1] | ||
|
Vorhandene Strukturdaten: 1anp, 1yk0 | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 28 Aminosäuren; 3,08 kDa | |
| Präkursor | Prepronatriodilatin | |
| Bezeichner | ||
| Gen-Namen | NPPA ; ANP; PND | |
| Externe IDs | ||
| Vorkommen | ||
| Übergeordnetes Taxon | Euteleostomi | |
| Orthologe | ||
| Mensch | Maus | |
| Entrez | 4878 | 230899 |
| Ensembl | ENSG00000175206 | ENSMUSG00000041616 |
| UniProt | P01160 | P05125 |
| Refseq (mRNA) | NM_006172 | NM_008725 |
| Refseq (Protein) | NP_006163 | NP_032751 |
| Genlocus | Chr 1: 11.85 – 11.85 Mb | Chr 4: 148 – 148 Mb |
| PubMed-Suche | 4878 | 230899 |
Die Höhe des Hormonspiegels wurde teilweise als Hinweis für den Schweregrad einer Herzinsuffizienz betrachtet, hat jedoch keinen diagnostischen Wert erreichen können. Im klinischen Alltag hat sich das verwandte BNP durchgesetzt[2]
Der Kanadier Adolfo J. de Bold und sein Team entdeckten ANP 1981.
Biosynthese
Das ANP-Gen hat drei Exons und zwei Introns, es codiert für ein 151 Aminosäuren großes Präpro-ANP, aus dem durch Abspaltung eines N-terminalen Signalpeptids (25 Aminosäuren) Pro-ANP wird. Corin, eine membranständige Serinprotease, spaltet ANP vom C-Terminus ab (28 Aminosäuren). Der Anfang und das Ende sind durch eine Disulfidbrücke zu einem Ring geschlossen. Außer im Herzen findet die Synthese in geringerem Umfang auch in Gehirn, Nebenniere und Niere statt. Das in Sammelrohrzellen aus Pro-ANP gebildete Urodilatin enthält 32 Aminosäuren und ist biologisch stabiler als ANP. Ein anderes Peptid, das aus Pro-ANP abgespalten wird, ist Cardiodilatin (CDP). Zwei verwandte natriuretische Peptide, die von anderen Genen codiert werden, sind BNP und CNP.
Physiologie und Biochemie
ANP wird bei erhöhtem Druck und Überdehnung der Herzvorhofwand vermehrt ausgeschüttet. Es ist an der Blutdruckregulation (genauer an der Blutdrucksenkung) beteiligt. Dabei wirkt es sowohl in der Niere als auch in der glatten Muskulatur der Arteriolen.
Das ANP ist ein vasodilatatorischer Botenstoff. Es verursacht durch Aktivierung (Bindung von ANP/BNP als Ligand am A-Rezeptor, CNP am B-Rezeptor und Homodimerisierung) von membranständigen Guanylylcyclasen einen Anstieg der intrazellulären cGMP-Konzentration. cGMP aktiviert die cGMP-abhängige Proteinkinase (PRKG1), welche durch Phosphorylierung ATP-abhängige Calciumpumpen in der Zellmembran aktiviert. Calcium-Ionen werden vermehrt aus der Zelle transportiert. Dadurch kommt es zur Relaxation der glatten Muskulatur. Des Weiteren bindet ANP (BNP und CNP) an einen weiteren Transmembranrezeptor (C-Rezeptor), dessen Aktivierung nicht zu einer cGMP-Erhöhung führt und für den eine Clearance-Funktion angenommen wird, der also überschüssiges ANP bindet und einem intrazellulären Abbau zuführt.[3]
ANP wirkt auch in der Niere: Es vermindert die Natriumrückgewinnung und führt damit zu einer erhöhten Natrium- und Chloridausscheidung. Da Natriumchlorid osmotisch aktiv ist, folgt Wasser. Durch die Vasodilatation, auch in den glomerulären Gefäßen, wird die Filtrationsrate gesteigert. Dies führt zu einer erhöhten Harnausscheidung und einem verminderten Plasmavolumen. Eine Verringerung des Plasmavolumens führt ebenfalls zu einem verminderten Blutdruck. In den Arteriolen führt ANP indirekt über die Senkung der Reninkonzentration zu einer Vasodilatation. Im Hypothalamus wird durch ANP das Durstgefühl gehemmt. In der Hypophyse wird die ADH-Ausschüttung herabgesetzt.
Eine weitere Wirkung ist die Hemmung des Renin-Angiotensin-Aldosteron-Systems, indem die Freisetzung sowohl von Renin als auch Aldosteron reduziert wird.
Einzelnachweise
- W. J. Fairbrother, R. S. McDowell, B. C. Cunningham: Solution conformation of an atrial natriuretic peptide variant selective for the type A receptor. In: Biochemistry. 33, Nr. 30, August 1994, S. 8897–8904. doi:10.1021/bi00196a006. PMID 8043577.
- Luchner et al.: Bedeutung der Herzinsuffizienzmarker BNP und NT-proBNP für die Klinik. In: Deutsches Ärzteblatt 2003; 100: Seiten A 3314 – A 3321.
- T. Tokudome, I. Kishimoto, T. Horio et al.: Regulator of G-protein signaling subtype 4 mediates antihypertrophic effect of locally secreted natriuretic peptides in the heart. In: Circulation. 117, Nr. 18, Mai 2008, S. 2329–2339. doi:10.1161/CIRCULATIONAHA.107.732990. PMID 18443239.