Alkylpolyglycoside
Alkylpolyglycoside (APGs) werden als Tenside verwendet. Sie sind nichtionische Tenside und zählen zu den Zuckertensiden. Sie werden als oberflächenaktiver Bestandteil von Waschmitteln, Geschirrspülmitteln und Reinigungsmitteln verwendet. Alkylpolyglycoside bestehen vollständig aus den nachwachsenden Rohstoffen Zucker, gewonnen aus Zuckerrohr und Zuckerrübe, und Fettalkoholen, gewonnen aus Palmölen. Sie sind biologisch abbaubar und haben eine geringe Toxizität.
Geschichte
Bereits 1931 wurde das erste Patent über Alkylglucoside in Deutschland angemeldet, das die Verwendung von Alkylglucosiden als Emulsions-, Reinigungs- sowie Benetzungsmittel z. B. in Seifen beschreibt.[1] Erst in den 1970er Jahren wurden Methoden zur industriellen Herstellung von APGs entwickelt. Dies ermöglichte schließlich am Ende der 1970er Jahre die Markteinführung des ersten, industriell produzierten Alkylglucosids durch Rohm and Haas. Das APG war ein Octyl/Decyl-polyglucosid. Dennoch konnte dieses APG nur für wenige Zwecke verwendet werden, da es u. a. eine nicht ausreichend grenzflächenaktive Substanz ist.
In den 1980er Jahren verlagerte sich die Produktion auf längerkettige Alkylreste, z. B. Dodecyl/Tetradecylpolyglycoside. APGs wurden zunehmend auch für Kosmetikprodukte hergestellt. Die industrielle Großproduktion von Alkylpolyglycosiden wurde schließlich 1992 eingeleitet: Der Konzern Henkel eröffnete ein Werk mit einer Jahreskapazität von ca. 25.000 Tonnen in Cincinnati (USA), 1995 auch in Düsseldorf. Weltweit existieren Kapazitäten von mehr als 80.000 Tonnen Alkylpolyglycoside pro Jahr.[2] Für Deutschland wird die jährliche Produktionsmenge mit 50.000 Tonnen angegeben.[3]
Eigenschaften
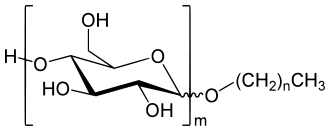
Alkylpolyglycoside bestehen allgemein aus einem Zuckerbestandteil, beispielsweise Glucose, und einem langkettigen Alkylrest. Der Zuckerbestandteil fungiert dabei als hydrophiler Bestandteil, der langkettige Alkylrest stellt die hydrophobe Gruppe im Alkylpolyglucosid dar. Moleküle, die einen beliebigen Glucosidzucker enthalten, heißen Alkylpolyglycoside. Alkylpolyglucoside dagegen werden Verbindungen mit Glucose als Zuckerkomponente genannt.[4]
In der industriellen Produktion liegen APGs als Mischung von Alkylglucosiden verschiedener Alkylkettenlänge, Polymerisierungsgrad des Zuckers, Anomere und Isomere vor. Die Fettalkohole haben meist eine Kettenlänge von 8 bis 14 C-Atomen, längere Ketten wie bsp. C16 führen zu sehr hydrophoben Produkten. Gewonnen werden diese Fettalkohole aus Palmölen.[2] Der Polymerisationsgrad des Zuckers liegt zwischen 1 (Alkylmonoglucosid) und 5 (Alkylpolyglucosid).
APGs sind hautverträglich, ungiftig und biologisch leicht abbaubar. In Verbindung mit anderen Tensiden wirken sie stark synergetisch, so dass 20 bis 50 % eingespart werden kann.[5]
Rohstoffe
Zur Herstellung von Alkylpolyglycosiden wird Glucose aus Zucker oder Stärke liefernden Pflanzen eingesetzt sowie Pflanzenöle wie Palmkernöl, in seltenen Fällen Kokos- als Lieferanten des Alkylrests.[4]
Herstellung
Die heutige Produktion von Alkylpolyglycosiden basiert auf den Synthesevorschriften von Emil Fischer. Hierbei werden als Ausgangsstoff sowohl Glucose selbst bzw. auch Polymere der Glucose (Stärke, Glucosesirup) säurekatalysiert mit Fettalkoholen (z. B. Dodecanol) umgesetzt. Die Säure dient als Katalysator, üblicherweise werden Schwefelsäure, p-Toluolsulfonsäure, Alkylbenzolsulfonsäure oder Sulfobernsteinsäure verwendet. Die Reaktionszeit und der Reaktionsverlauf müssen gut kontrolliert werden, zumal die Synthese nicht stereospezifisch ist.
Es bestehen zwei Verfahren zur Herstellung von APGs. Entweder werden diese in einer Direktsynthese aus Glucose und z. B. Dodecylpoly-/Tetradecylpolyglucosid einstufig synthetisiert. Dies geschieht bei Temperaturen von 120 °C und einem Druck von 2.000 Pa. Es entsteht ein komplexes Produktgemisch aus Alkylmono-, Alkyloligo- und Alkylpolyglucosid. Daneben lassen sich auch andere Nebenprodukte wie Ether oder Glucosepolymere im Reaktionsgemisch nachweisen.
Alternativ können APGs auch zweistufig über eine Umacetylierung dargestellt werden, was aber apparativ schwieriger ist. Zunächst findet die Umsetzung mit einem kurzkettigen Alkohol, z. B. Butanol bei ca. 115 °C und Normaldruck bei Glucose und 140 °C und 400.000 Pa bei Stärke als Ausgangsrohstoff statt. In einer zweiten Reaktion wird das kurzkettige Alkylglucosid mit einem langkettigen Alkohol, z. B. Dodecanol, bei Temperaturen von 120 °C und einem Druck von 2.000 Pa zu einem langkettigen Alkylglucosid umacetalisiert.
Nutzung
Alkylpolyglycoside sind hydrolysebeständig und besitzen aufgrund ihres HLB-Wertes von >10 ein gutes Schmutzlöse- und Schmutztragevermögen. Sie sind stark schäumend und besitzen keine hautreizenden Inhaltsstoffe, weshalb sie gern in Geschirrspülmitteln für den Handabwasch eingesetzt und mit linearen Alkylbenzolsulfonaten (LAS) und Fettalkoholsulfaten (FAS) kombiniert werden.[2] Auch in Leichtwaschmitteln werden sie aufgrund ihrer Eigenschaften als Zusatzstoff verwendet.[2]
In der Kosmetikindustrie werden Alkylpolyglycoside als Bestandteile von Shampoos, Haarspülungen, Badezusätzen und Hautreinigungsmitteln verwendet. Stark hydrophobe APGs mit 16-C-Kohlenstoffketten dienen als Emulgatoren in Kosmetika und Schaumbremsern.[2]
Die großtechnische Verwendung konzentriert sich vor allem auf den Bereich der Reinigungsmittel in der Lebensmittel- und Brauereiindustrie, wo nichtionische oder anionische Tenside aufgrund ihrer schlechten Löslichkeit und der starken Schaumbildung nicht eingesetzt werden können. Gemeinsam mit modifizierten Fettaminethoxylaten können wenig schäumende oder sogar schaumbremsende Reiniger auf der Basis von Natronlauge-Lösungen hergestellt werden.[2]
Literatur
- Manfred Biermann, Karl Schmid, Paul Schulz: Alkylpolyglucoside – Technologie und Eigenschaften. Band 45, Nr. 5: Starch – Stärke. S. 281–288, doi:10.1002/star.19930450807.
- Rybinski, W. und Hill, K. (1998): Alkylpolyglycoside – Eigenschaften und Anwendungen einer neuen Tensidklasse. In: Angew. Chem., 110, Nr. 10, S. 1394–1412, doi:10.1002/(SICI)1521-3757(19980518)110:10<1394::AID-ANGE1394>3.0.CO;2-T.
Einzelnachweise
- H. Th. Böhme AG, DRP (Offenlegungsschrift) 593422 1931.
- Stichwort Alkyl Polyglycosides In: Hans Zoebelein (Hrsg.): Dictionary of Renewable Ressources. 2. Auflage, Wiley-VCH, Weinheim und New York 1996, ISBN 3-527-30114-3; S. 92.
- Fachagentur Nachwachsende Rohstoffe (Hrsg.) 2006: Marktanalyse Nachwachsende Rohstoffe. Gülzow (pdf, 16 MB).
- Günter Wagner: Waschmittel - Chemie, Umwelt, Nachhaltigkeit. 4. Auflage. John Wiley & Sons, Weinheim 2011, ISBN 978-3-527-64366-0, S. 47–48 (eingeschränkte Vorschau in der Google-Buchsuche).
- Wittko Francke und Wolfgang Walter: Lehrbuch der Organischen Chemie. S. Hirzel Verlag Stuttgart; 24. überarb. Auflage 2004, ISBN 3-7776-1221-9; S. 472.