Achmatowicz-Reaktion
Die Achmatowicz-Reaktion oder Achmatowicz-Umlagerung, ist eine organische Namensreaktion, in welcher ein Furan in ein Dihydropyran umgewandelt wird.
Geschichte
Die Bildung von Furanen aus Mono- und Polysacchariden unter Einwirkung von Mineralsäuren war bereits im 19. Jahrhundert bekannt. Bereits im Jahr 1832 konnte Johann Wolfgang Döbereiner durch das Erwärmen von Zuckern mit Schwefelsäure und Mangan(IV)-oxid das giftige Öl Furfural herstellen.[1] Im Jahr 1970 konnten K. Tsuji und I. Fujimaki durch Erwärmen eines Streptosederivats bei pH 2–4 das 2-Methyl-3-formylfuran gewinnen.[2]
Im Jahr 1971 haben O. Achmatowicz Jr., P. Bukowski, B. Szechner, Z. Zwierzchowska und A. Zamojski am Institut für organische Chemie an der Polnischen Akademie der Wissenschaften die umgekehrte Reaktion zur Herstellung von Zuckern aus Furanderivaten, insbesondere die Herstellung von Monosacchariden aus einfachen Furanen entwickelt. Dabei wird ein Furfurylalkohol mit Brom in Methanol zur Reaktion gebracht und bildet schließlich ein Stereoisomerengemisch aus cis- und trans-Isomeren des 2,5-Dimethoxy-2,5-dihydrofuranderivats. Anschließend reagiert es mit verdünnter Schwefelsäure unter Spaltung des Acetals zu einer Dicarbonylkomponente, die unmittelbar zu einem Dihydropyranderivat cyclisiert.[3]
Anwendung
Weitere Schritte der Reaktion sind der Schutz des Alkohols mit Orthoameisensäuretrimethylester und Bortrifluorid, gefolgt von der Reduktion der formierten Ketone mit Natriumborhydrid, wodurch ein Zwischenprodukt entsteht, aus dem viele Monosaccharide synthetisiert werden können.
Basisreaktion
Die Achmatowitz-Reaktion wurde zur Totalsynthese genutzt, einschließlich der von Desoxoprosophyllin und[4] Pyrenophorin.[5][6]
Das Verfahren wird auch bei der divergenten Synthese genutzt.[7][A 1]
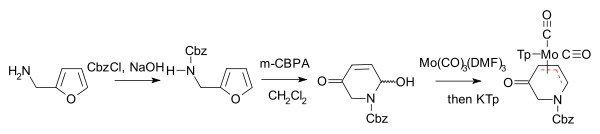
Achmatowicz-Burke 2006
Achmatowicz-Reaktion 2008
Anmerkungen
- Reaktanten: NBS, Pyridin-p-Toluolsulfonat (PPTS).
Einzelnachweise
- J. W. Döbereiner: Ueber die medicinische und chemische Anwendung und die vortheilhafte Darstellung der Ameisensäure. In: Annalen der Pharmacie. Band 3, 1832, S. 141.
- K. Tsuji, I. Fujimaki: Formation of 2-methyl-3-formylfuran from reduced streptomycin. In: Tetrahedron Letters. Band 48, Oktober 1970, S. 4229.
- O. Achmatowicz, P. Bukowski, B. Szechner, Z. Zwierzchowska und A. Zamojski: Synthesis of methyl 2,3-dideoxy-alk-2-enopyranosides from furan compounds : A general approach to the total synthesis of monosaccharides. In: Tetrahedron. Band 27, Nr. 10, 1971, S. 1973–1996 (englisch).doi:10.1016/S0040-4020(01)98229-8.
- Cui-Fen Yang, Yi-Ming Xu, Li-Xin Liao und Wei-Shan Zhou: Asymmetric total synthesis of (+)-desoxoprosophylline. In: Tetrahedron Letters. Band 39, Nr. 50, 10. Dezember 1998, S. 9227–9228 (englisch).doi:10.1016/S0040-4039(98)02129-7.
- Kobayashi, Y.; Nakano, M.; Kumar, G. B.und Kishihara, K.: Efficient Conditions for Conversion of 2-Substituted Furans into 4-Oxygenated 2-Enoic Acids and Its Application to Synthesis of (+)-Aspicilin, (+)-Patulolide A, and (−)-Pyrenophorin. In: J. Org. Chem. Band 63, Nr. 21, 1998, S. 7505–7515 (englisch). doi:10.1021/jo980942a.
- Yongqiang Zhang und Lanny S. Liebeskind: Organometallic Enantiomeric Scaffolding: Organometallic Chirons. Total Synthesis of (−)-Bao Gong Teng A by a Molybdenum-Mediated [5+2] Cycloaddition. In: J. Am. Chem. Soc. Band 128, 2006, S. 465–472. doi:10.1021/ja055623x.
- Martin D. Burke, Eric M. Berger und Stuart L. Schreiber: A Synthesis Strategy Yielding Skeletally Diverse Small Molecules Combinatorially. In: J. Am. Chem. Soc. Band 126, Nr. 43, 2004, S. 14095–14104 (englisch). doi:10.1021/ja0457415.