5-Hexin-1-ol
5-Hexin-1-ol ist eine chemische Verbindung aus der Stoffgruppe der ungesättigten Alkohole.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemeines | |||||||||||||||||||
| Name | 5-Hexin-1-ol | ||||||||||||||||||
| Summenformel | C6H10O | ||||||||||||||||||
| Kurzbeschreibung |
klare, dunkelbraune Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 98,14 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
0,89 g·cm−3[1] | ||||||||||||||||||
| Siedepunkt |
73–75 °C[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
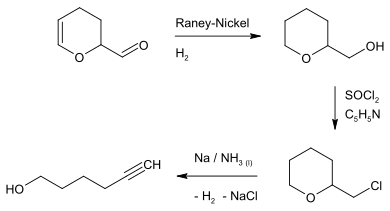
Darstellung
5-Hexin-1-ol kann in wenigen Schritten ausgehend vom Dimer des Acroleins hergestellt werden. Dieses muss zum Tetrahydro-2H-pyran-2-ylmethanol hydriert werden,[2] dann chloriert werden und mit elementarem Natrium in flüssigem Ammoniak der Ring gespalten werden.[3][4][5]
Verwendung
5-Hexin-1-ol kann in Naturstoffsynthesen wie der von 9-Hydroxyeicosatetraensäure[4] und Phomoidrid B und A[6] oder auch als Spacer / Linker in der Enzymtechnik / Polymertechnik verwendet werden.[7]
Einzelnachweise
- Datenblatt 5-Hexin-1-ol bei Sigma-Aldrich, abgerufen am 24. Februar 2020 (PDF).
- H. Helberger, S. Ulubay, H Civelekoglu: Ein einfaches Verfahren zur Gewinnung von alpha-Angelicalacton und über die hydrierende Spaltung sauerstoffhaltiger Ringe. In: Justus Liebigs Annalen der Chemie. Band 561, 1949, S. 215–220, doi:10.1002/jlac.19495610307.
- G. Eglinton, E. R. H. Jones, M. C. Whiting: Researches on Acetylenic Compounds. Part XXXVIII.* A New Method for the Introduction of the Acetylenic Linkage. In: J. Chem. Soc. Nr. 545, 1952, S. 2873–2882, doi:10.1039/JR9520002873.
- J. S. Yadav, L. R. M. Bhanu, D. Dutta: Stereoselective Total Syntheses of 9(S)- and B(R)-HETE. In: Tetrahedron. Band 54, Nr. 15, 1998, S. 3929–3934, doi:10.1016/s0040-4020(98)00119-7.
- H. Schulz, H. Wagner: Synthese und Umwandlungsprodukte des Acroleins. In: Angewandte Chemie. Band 62, Nr. 5, 1950, S. 105–118, doi:10.1002/ange.19500620502.
- C. Chen, M. E. Layton, S. M. Sheehan, M. D. Shair: Synthesis of (+)-CP-263,114. In: JACS. Band 122, Nr. 30, 2000, S. 7424–7425, doi:10.1021/ja001958x.
- I. Javakhishvili, W. H. Binder, S. Tanner, S. Hvilsted: Facile synthesis of linear-dendritic cholesteryl-poly(3-caprolactone)-b-( L -lysine) G2 by thiol-ene and azide-alkyne ‘‘click’’ reactions. In: Polym. Chem. Band 1, Nr. 4, 2010, S. 506–513, doi:10.1039/B9PY00303G.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. The authors of the article are listed here. Additional terms may apply for the media files, click on images to show image meta data.
