3-Desoxyarabinoheptulosanat-7-phosphat-Synthase
3-Desoxyarabinoheptulosanat-7-phosphat-Synthase (DAHP-Synthase) ist ein Enzym, das zum größten Teil in Bakterien, aber auch in Eukaryoten und Archaeen verkommt. Das Enzym zu den sogenannten DAHP-Synthasen, die die erste enzymatische Reaktion des Shikimisäurewegs katalysieren.
| 3-Desoxyarabinoheptulosanat-7-phosphat-Synthase (E. coli) | ||
|---|---|---|
| ||
| Bändermodell der 3-Desoxyarabinoheptulosanat-7-phosphat-Synthase | ||
| Andere Namen |
DAHP-Synthase | |
| Masse/Länge Primärstruktur | 356 Aminosäuren, 38.804 Da | |
| Sekundär- bis Quartärstruktur | Tetramer | |
| Kofaktor | ein bivalentes Metallion | |
| Isoformen | 3 | |
| Bezeichner | ||
| Gen-Name(n) | aroF, aroG, aroH | |
| Externe IDs |
| |
| Enzymklassifikation | ||
| EC, Kategorie | 2.5.1.54, Transferase | |
| Reaktionsart | Kondensation | |
| Substrat | Erythrose-4-phosphat + PEP + H2O | |
| Produkte | 3-Desoxyarabinoheptulosanat-7-phosphat + Pi | |
| Vorkommen | ||
| Homologie-Familie | HOG000220501 | |
| Übergeordnetes Taxon | Bacteria, Eukaryota | |
| Orthologe (E. coli) | ||
| Entrez | 947084 | |
| UniProt | P00888 | |
| Refseq (Protein) | NP_417092.1 | |
| PubMed-Suche | 947084 | |
Innerhalb der DAHP-Synthasen wird derzeit zwischen zwei Klassen unterschieden, wobei eine Klasse ausschließlich Enzyme von Pflanzen umfasst und die andere sich auf Enzyme von Mikroorganismen beschränkt, zu der auch die 3-Desoxyarabinoheptulosanat-7-phosphat-Synthase gehört.[1]
Eigenschaften

Neben der Katalyse der ersten enzymatischen Reaktion im Shikimisäureweg ist das Enzym auch für die Regulierung des im Stoffwechselweg eingetretenen Kohlenstoffgehalts verantwortlich, die durch Feedback-Inhibition (Produkthemmung) und transkriptionale Regulierung gesteuert wird. Beide Steuerungsmechanismen regulieren den Kohlenstoffgehalt in Bakterien, wobei bei den DAHP-Synthasen in Pflanzen nur die transkriptionale Regulierung zur Regulierung des Kohlenstoffgehalts Anwendung findet.[2]
In Escherichia coli befinden sich drei solcher Isoenzyme, die jeweils durch eine der drei aromatischen Aminosäuren Phenylalanin, Tyrosin und Tryptophan, die im Shikimisäureweg synthetisiert werden, durch Feedback-Hemmung inhibiert werden.[3]
Die Isoenzyme besitzen jeweils den gleichen Reaktionsmechanismus, ähnliche kinetische Konstanten und eine ähnliche Metallaktivierung. Unterschiede gibt es in der jeweiligen regulatorischen Spezifität, Quartärstruktur, Substrat- und Inhibitorbindung sowie der Hemmungskinetik. Das Monomer einer DAHP-Synthase besitzt eine einzelne (β/α)8-Fassdomäne, die durch verschiedene zusätzliche Elemente verstärkt wird. Die Fassdomäne wird durch acht parallele β-Faltblätter gebildet, die mit acht α-Helices miteinander verbunden sind. Typisch für (β/α)8-Fässer ist die Position des aktiven Zentrums am C-Terminus des Fasses.[4] Das allosterische Zentrum für die Feedback-Inhibition besteht aus den Resten zweier benachbarter Untereinheiten, die sich ca. 20 Å vom aktiven Zentrum befinden.[5]
Reaktion
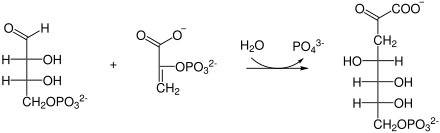
Erythrose-4-phosphat und Phosphoenolpyruvat werden mit Wasser zu 3-Desoxyarabinoheptulosanat-7-phosphat und Phosphat umgesetzt.
Verwendung
Bei einer Vervielfältigung (Amplifizierung) der DAHP-Synthase in E.-coli-Mutanten mit effizientem Glucosetransport ohne Phosphotransferasesystem können einige Phosphoenolpyruvat(PEP)-Moleküle, die während des Glucosetransports gespeichert wurden, in den Shikimisäureweg überführt werden.[6]
Einzelnachweise
- G. E. Walker, B. Dunbar, l. S. Hunter, H. G. Nimmo, J. R. Coggins: Evidence for a novel class of microbial 3-deoxy-D-arabino-heptulosonate-7-phosphate synthase in Streptomyces coelicolor A3(2), Streptomyces rimosus and Neurospora crassa. In: Microbiology. 142, 1996, S. 1973, doi:10.1099/13500872-142-8-1973.
- Klaus Herrmann, Robert Entus: Shikimate Pathway: Aromatic Amino Acids and Beyond. In: Encyclopedia of Life Sciences. 2001, ISBN 978-0-470-01617-6, doi:10.1038/npg.els.0001315 (englisch).
- R. Schoner, K. M. Herrmann: 3-Deoxy-D-arabino-heptulosonate 7-phosphate synthase. Purification, properties, and kinetics of the tyrosine-sensitive isoenzyme from Escherichia coli. In: The Journal of biological chemistry. Band 251, Nummer 18, September 1976, S. 5440–5447, PMID 9387.
- I. A. Shumilin, R. H. Kretsinger, R. H. Bauerle: Crystal structure of phenylalanine-regulated 3-deoxy-D-arabino-heptulosonate-7-phosphate synthase from Escherichia coli. In: Structure. Band 7, Nummer 7, Juli 1999, S. 865–875, PMID 10425687.
- I. A. Shumilin, C. Zhao, R. Bauerle, R. H. Kretsinger: Allosteric inhibition of 3-deoxy-D-arabino-heptulosonate-7-phosphate synthase alters the coordination of both substrates. In: Journal of molecular biology. Band 320, Nummer 5, Juli 2002, S. 1147–1156, PMID 12126632.
- N. Flores, J. Xiao, A. Berry, F. Bolivar, F. Valle: Pathway engineering for the production of aromatic compounds in Escherichia coli. In: Nature Biotechnology. Band 14, Nummer 5, Mai 1996, S. 620–623, doi:10.1038/nbt0596-620, PMID 9630954.